|
|
Fibrilatia atriala
I. Introducere
Fibrilatia atriala (FA) este cea mai intalnita aritmie sustinuta, a carei prevalenta este in crestere odata cu varsta. FA este deseori asociata cu boala cardiaca structurala, desi o proportie substantiala din pacientii cu FA nu au afectare cardiaca detectabila. Tulburarile hemodinamice si evenimentele tromboembolice datorate FA au impact major asupra morbiditatii, mortalitatii si costurilor. In consecinta, The American College of Cardiology (ACC), The American Heart Association (AHA) si European Society of Cardiology (ESC) au creat un comitet in vederea elaborarii unui ghid pentru managementul optim al acestei aritmii frecvente si complexe.
Comitetul a fost alcatuit de reprezentanti ai ACC, AHA, ESC, European Heart Rhythm Association (EHRA) si ai Heart Rhythm Society (HRS). Documentul a fost revizuit de membrii numiti de aceste organizatii si va fi reanalizat anual de catre Task Force si este considerat in vigoare pana cand va fi modificat sau retras de catre Task Force.
Comitetul de redactare ACC/AHA/ESC insarcinat cu revizuirea Ghidului de management al pacientilor cu fibrilatie atriala publicat in 2001 a efectuat o analiza cuprinzatoare a literaturii relevante din perioada 2001-2006, folosind bazele de date PubMed/Medline si Cochrane Library. Cercetarea a fost concentrata asupra surselor in limba engleza si asupra studiilor cu subiecti umani. Articolele legate de experimentele pe animale au fost citate atunci cand contribuie la intelegerea conceptelor legate de managementul pacientului.
Clasa I: conditii in care exista do si/sau consens ca o anumita procedura/terapie este benefica, utila si eficienta
Clasa II: conditii pentru care exista do conflictuale si/sau opinii divergente privind utilitatea/eficacitatea unei proceduri/terapii.
o Clasa IIa: dole/opinia expertilor este mai degraba in favoarea utilitatii/eficacitatii
o Clasa IIb: utilitatea/eficacitatea sunt mai putin sustinute de do/opinia expertilor
Clasa III: conditii pentru care exista do/consens ca o anumita procedura/terapie nu este utila sau eficienta iar in anumite cazuri poate fi daunatoare.
Importanta dolor a fost clasificata de la cea mai mare (A) la cea mai mica (C) dupa cum urmeaza:
Nivel de do A: datele deriva din multiple studii clinice randomizate sau metaanalize
Nivel de do B: datele deriva dintr-un singur studiu randomizat sau din studii nerandomizate
Nivel de do C: doar consensul expertilor, studii de caz sau practica obisnuita.
Comitetul de redactare a luat in considerare dole publicate dupa 2001 si a schitat noile recomandari care sa incorporeze rezultatele marilor studii clinice precum cele care au at strategiile de control al frecventei cardiace si cele de mentinere a ritmului sinusal in managementul pe termen lung al pacientilor cu FA. Textul a fost reorganizat astfel incat sa evidentieze punctele majore ale ingrijirii pacientului, incepand cu recunoasterea FA si a patogenezei ei si prioritatile generale ale controlului frecventei, preventiei tromboembolismului si metodele disponibile utile la pacienti selectati pentru corectarea aritmiei si mentinerea ritmului sinusal. Progresele in tehnicile de ablatie prin cateter sunt incluse in sectiuni separate cu mentiunea ca anumite detalii importante precum selectia pacientilor, pozitionarea optima a cateterului, ratele absolute de succes ale tratamentului si frecventa complicatiilor raman incomplet definite. Sectiunile referitoare la terapia medicamentoasa au fost elaborate pe baza studiilor pe subiecti umani si cu compusi aprobati pentru uzul clinic in America de Nord si Europa. Deoarece datele privind managementul FA in situatii particulare sunt mai ample, recomandarile din ghidul actual sunt bazate pe un nivel de do mai ridicat decat in ghidul precedent. S-au facut eforturi pentru corelarea recomandarilor din prezentul document cu celelalte ghiduri de practica medicala ale ACC/AHA si ESC.
Clasificarea recomandarilor si nivelul de do sunt prezentate in formatul ACC/AHA/ESC si descrise in Tabelul 1. Recomandarile sunt bazate pe do si deriva in principal pe date publicate. Cititorul este indrumat sa consulte ghidul in format complet pentru o descriere exhaustiva a ratiunilor si dolor care sustin aceste recomandari.
Masurarea frecventei cardiace de repaus si controlul acesteia folosind agenti farmacologici (in cele mai multe cazuri un betablocant, sau un blocant de canal calcic non-dihidropiridinic) sunt recomandate la pacientii cu FA persistenta sau permanenta. (nivel de dovezi: B).
In absenta preexcitatiei, administrarea intravenoasa de betablocante (esmolol, metoprolol sau propranolol) sau de blocanti de canal calcic non-dihidropiridinici (verapamil, diltiazem) este recomandata pentru scaderea frecventei ventriculare in faza acuta la pacientii cu FA, cu precautie in cazul pacientilor cu hipotensiune sau insuficienta cardiaca (IC). (nivel de do: B).
Administrarea intravenoasa de digoxin sau amiodarona in vederea controlului frecventei ventriculare este recomandata la pacientii cu FA si IC care nu au un tract accesor. (nivel de do: B).
La pacientii cu simptome legate de FA in timpul efortului, eficacitatea controlului frecventei cardiace trebuie evaluata in timpul efortului fizic, ajustand tratamentul farmacologic astfel incat aceasta sa se mentina in limite fiziologice. (nivel de do: C).
Digoxinul este eficient in administrare orala pentru controlul frecventei ventriculare de repaus la pacientii cu FA si este recomandat la cei cu IC, disfunctie de ventricul stang (VS) si la persoanele sedentare. (nivel de do: C)
Tabelul 1. Aplicarea clasei de recomandare si a nivelului de dob
Marimea efectului tratamentului
|
|
Clasa I Beneficiu >>> risc Procedura/tratamentul AR TREBUI efectuata/administrat |
Clasa IIa Beneficiu >> risc Sunt necesare studii aditionalecu obiective specifice Este rationala efectuarea/administrarea procedurii/tratamentului |
Clasa IIb Beneficiu ³ risc Sunt necesare studii aditionale cu obiective extinse; date aditionale provenite din registre ar fi utile Procedura/tratamentul poate fi luata in considerare |
Clasa III Risc ³ beneficiu Nu sunt necesare studii suplimentare Procedura/tratamentul NU AR TREBUI efectuat deoarece NU ESTE UTIL SI POATE FI NOCIV |
|
Nivel A Multiple (3-5) straturi de risc populational evaluatea. Corelare generala privind directia si magnitudinea efectului |
Recomandarea ca procedura/tratamentul este util/eficient Do suficiente provenite din multiple studii randomizate sau metaanalize |
Recomandarea in favoarea procedurii/tratamentului care pot fi util/eficient Do conflictuale din multiple studii randomizate sau metaanalize |
Utilitatea/eficienta sunt mai putin stabilite Do puternic divergente din studii randomizate sau metaanalize |
Recomandarea ca procedura/tratamentul nu este utila/eficienta si poate fi nociva Do suficiente provenite din multiple studii randomizate sau metaanalize |
|
Nivel B Numar limitat (2-3) de straturi de risc populational evaluata |
Recomandarea ca procedura/tratamentul este util/eficient Do limitate dintr-un singur studiu randomizat sau din studii nerandomizate |
Recomandarea in favoarea procedurii/tratamentului care pot fi util/eficient Do conflictuale dintr-un studiu randomizat sau studii nerandomizate |
Utilitatea/eficienta sunt mai putin stabilite Do puternic divergente dintr-un studiu randomizat sau studii nerandomizate |
Recomandarea ca procedura/tratamentul nu este utila/eficienta si poate fi nociva Do limitate dintr-un singur studiu randomizat sau din studii nerandomizate |
|
Nivel C Foarte putine straturi de risc (1-2) evaluatea |
Recomandarea ca procedura/tratamentul este util/eficient Doar opiniile expertilor, studii de caz, sau practica curenta |
Recomandarea in favoarea procedurii/tratamentului care pot fi util/eficient Opinii divergente ale expertilor, studii de caz sau practica curenta |
Utilitatea/eficienta sunt mai putin stabilite Opinii divergente ale expertilor, studii de caz sau practica curenta |
Recomandarea ca procedura/tratamentul nu este utila/eficienta si poate fi nociva Doar opiniile expertilor, studii de caz, sau practica curenta |
a Date provenite din studii clinice sau registre cu privire la utilitate/eficienta in diferite subpopulatiiprecum sex, varsta, istoric de diabet, istoric de infarct miocardic, istoric de insuficienta cardiaca si consum anterior de aspirina. O recomandare de nivel B sau C nu inseamna ca este slaba. Multe intrebari clinice importante ridicate in acest ghid nu recurg la studii clinice. Chiar daca nu sunt disponibile studii randomizate poate fi un consens foarte clar ca o procedura sau o terapie anume este utila sau eficienta.
b In 2003, ACC/AHA Task Force on Practice Guidelines a creat o lista de fraze ce trebuie utilizate pentru redactarea recomandarilor.Toate recomandarile din ghid sunt scrise sub forma de propozitie completa ce exprima o judecata completa, astfel incat fraza, chiar separata de restul textului documentului (inclusiv prin titlurile de deasupra setului de recomandari) poate transmite intreaga intentie a recomandarii.Se spera prin aceasta ca va fi imbunatatita intelegerea ghidului de catre cititor si va permite ridicarea de probleme la nivelul recomandarii individuale.
Asocierea digoxinului cu un betablocant sau un blocant de canal calcic nondihidropiridinic este rationala pentru controlul frecventei cardiace, atat in repaus, cat si la efort la pacientii cu FA. Alegerea medicatiei trebuie individualizata si dozele trebuie modulate pentru evitarea bradicardiei. (nivel de do: B).
Folosirea ablatiei nodului AV sau a tractului accesor pentru controlul frecventei cardiace este judicioasa atunci cand terapia farmacologica este insuficienta sau este asociata cu efecte secundare. (nivel de do: B).
Administrarea de amiodarona intravenos poate fi utila pentru controlul frecventei cardiace la pacientii cu FA atunci cand alte masuri sunt ineficiente sau contraindicate. (nivel de do: C).
Atunci cand conversia electrica nu este necesara la pacientii cu FA si tract accesor, administrarea intravenoasa de procainamida sau ibutilid este o alternativa acceptabila. (nivel de do: C).
Atunci cand frecventa ventriculara nu poate fi controlata adecvat, atat in repaus cat si la effort, la pacientii cu FA prin utilizarea de betablocant, blocant de canal calcic nondihidropiridinic sau digoxin, singur sau in combinatie, se poate administra amiodarona oral pentru controlul frecventei cardiace. (nivel de do: C).
Administrarea intravenoasa de procainamida, disopiramida, ibutilid sau amiodarona poate fi luata in considerare la pacientii cu FA stabili din punct de vedere hemodinamic si cu conducere prin tract accesor. (nivel de do: B).
Cand frecventa cardiaca nu poate fi controlata prin terapie farmacologica sau atunci cand se suspecteaza o tahicardiomiopatie, ablatia prin cateter a nodului AV poate fi luata in considerare la pacientii cu FA pentru controlul frecventei cardiace. (nivel de do: C).
Digoxinul nu trebuie utilizat singur pentru controlul frecventei cardiace la pacientii cu FA paroxistica. (nivel de do: B).
Ablatia prin cateter a nodului AV nu trebuie efectuata fara a incerca in prealabil terapia farmacologica pentru controlul frecventei ventriculare la pacientii cu FA. (nivel de do: C).
La pacientii cu FA si IC decompensata, administrarea intravenoasa a unui blocant de canal calcic nondihidropiridinic poate exacerba deteriorarea hemodinamica si nu este recomandata. (nivel de do: C).
Administrarea intravenoasa de digoxin sau de blocanti de canal calcic nondihidropiridinici la pacientii cu FA si preexcitatie poate accelera in mod paradoxal frecventa ventriculara si nu este recomandata. (nivel de do: C).
(Pentru recomandari privind terapia antitrombotica la pacientii cu FA care urmeaza sa fie convertiti a se vedea submodulul I.C.3.d.).
Terapia antitrombotica pentru preventia tromboembolismului este recomandata pentru toti pacientii cu FA, cu exceptia celor cu FA lone sau a celor care au contraindicatii pentru acest tip de tratament. (Nivel de evidenta A)
Selectia tratamentului antirombotic adecvat se va face pe baza estimarii riscurilor absolute de accident vascular derebral (AVC) ischemic si de hemoragie, precum si a riscului relativ si a beneficiului pentru fiecare pacient in parte. (Nivel de evidenta A)
Pentru pacientii fara proteze valvulare mecanice, dar cu risc inalt pentru AVC ischemic este recomandata terapia anticoagulanta orala cu un antagonist de vitamina K in doza ajustata pentru a atinge un INR tinta intre 2,0 si 3,0, cu exceptia cazurilor in care acest tip de tratament este contraindicat. Factorii asociati cu riscul cel mai mare de AVC ischemic sunt antecedentele de tromboembolism (AVC, accident ischemic tranzitoriu sau embolia sistemica) si stenoza mitrala postreumatismala. (Nivel de evidenta A)
Anticoagularea cu un antagonist al vitaminei K este recomandata pacientilor care au mai mult de un factor de risc moderat. Acesti factori de risc sunt varsta de 75 ani sau mai mult, hipertensiunea arteriala, IC, disfunctia sistolica a VS (fractia de ejectie de 35% sau mai putin, sau fractia de scurtare mai mica de 25%) si diabetul zaharat. (Nivel de evidenta A)
Dozarea INR trebuie realizata cel putin o data pe saptamana la inceputul tratamentului si apoi lunar, odata stabilizata doza de anticoagulant optima. (Nivel de evidenta A)
Aspirina in doza de 81-325mg/zi este recomandata ca alternativa la tratamentul cu antagonisti ai vitaminei K la pacientii cu risc scazut sau celor care au contraindicatii pentru anticoagulant oral. (Nivel de evidenta A)
Pentru pacientii cu proteze valvulare mecanice se recomanda ca intensitatea anticoagularii sa fie in functie de tipul de proteza pe care o are pacientul, mentinandu-se un INR de cel putin 2,5. (Nivel de evidenta B)
Terapia antitrombotica este recomandata la pacientii cu flutter atrial in aceeasi modalitate ca si la pacientii cu FA. (Nivel de evidenta C)
Pentru preventia primara a tromboembolismului la pacientii cu FA non-valvulara care au doar unul din factorii de risc tromboembolic validati, este justificata terapia antitrombotica fie cu aspirina, fie cu antagonisti ai vitaminei K, luandu-se in calcul riscul de complicatii hemoragice, posibilitatea pacientului de a fi anticoagulat cronic in siguranta, precum si preferintele sale. Factorii de risc tromboembolic validati sunt urmatorii varsta de 75 ani sau mai mare (in special la femei), hipertensiunea arteriala, IC, disfunctia de VS si diabetul zaharat. (Nivel de evidenta A)
Pentru pacientii cu FA non-valvulara care au unul sau mai multi din urmatorii factori de risc mai putin validati, tratamentul fie cu aspirina, fie cu antagonisti ai vitaminei K este justificat pentru preventia tromboembolismului varsta intre 64 si 75 ani, sexul feminin si boala coronariana. Alegerea uneia din cele 2 variante se va baza pe calculul riscului de complicatii hemoragice, posibilitatea pacientului de a fi anticoagulat cronic in siguranta, precum si pe preferintele sale. (Nivel de evidenta B)
Este justificata utilizarea acelorasi criterii pentru alegerea terapiei antitrombotice independent de tipul de FA (de ex. paroxistica, persistenta sau permanenta). (Nivel de evidenta B)
La pacientii fara proteza valvulara mecanica se poate intrerupe terapia anticoagulanta pana la o saptamana fara a fi necesara substitutia cu heparina atunci cand sunt supusi unor proceduri chirurgicale sau diagnostice care implica un risc hemoragic. (Nivel de evidenta C)
Este justificata reevaluarea la intervale regulate a necesitatii mentinerii anticoagularii. (Nivel de evidenta C)
La pacientii in varsta de 75 ani sau mai mult care au risc crescut de complicatii hemoragice, dar fara contraindicatii clare pentru anticoagularea orala, precum si la pacientii cu factori de risc moderat pentru tromboembolism care nu pot tolera in siguranta un nivel de anticoagulare standard (INR intre 2,0 si 3,0), se poate accepta un nivel INR mai mic (intre 1,6 si 2,5) pentru preventia primara a AVC ischemic si a emboliei sistemice. (Nivel de evidenta C)
In situatiile in care o interventie chirurgicala impune o intrerupere a terapiei anticoagulante pe o durata de mai mult de o saptamana, la pacientii cu risc inalt se pot administra fie heparina nefractionata, fie heparina cu greutate moleculara mica subcutanat, cu toate ca eficienta acestor alternative in aceaste situatii este neclara. (Nivel de evidenta C)
Dupa interventiile de revascularizare coronariana percutana sau chirurgicala la pacientii cu FA se poate administra concomitent cu anticoagulantul oral aspirina in doza mica (mai putin de 100mg/zi) si/sau clopidogrel 75mg/zi cu scopul de a preveni eventualele episoade de ischemie miocardica, insa aceste asocieri nu au fost evaluate exhaustiv si sunt asociate unui risc hemoragic crescut. (Nivel de evidenta C)
La pacientii supusi unei interventii coronariene percutane se poate intrerupe temporar anticoagularea orala pentru a preveni sangerarea la nivelul locului de punctie arteriala, insa antagonistul de vitamina K va fi reluat cat mai rapid posibil la doza necesara obtinerii unui INR in intervalul tinta. In aceasta perioada se poate administra temporar aspirina, insa tratamentul de mentinere ulterior ar trebui sa consiste din clopidogrel 75mg/zi plus warfarina pentru INR intre 2,0 si 3,0. Clopidogrelul trebuie administrat pentru o perioada de minimum o luna dupa imtarea unui stent metalic simplu, de cel putin 3 luni pentru un stent acoperit cu sirolimus, 6 luni pentru un stent acoperit cu paclitaxel si 12 luni sau mai mult la pacienti selectionati, dupa care warfarina poate fi continuata ca monoterapie in absenta unui eveniment coronarian ulterior. Doza de warfarina trebuie atent urmarita atunci cand este administrata concomitent cu aspirina in doza mica sau cu clopidogrel. (Nivel de evidenta C)
La pacientii mai tineri de 60 ani fara boala cardiaca si fara factori de risc pentru tromboembolism (FA lone), riscul de embolie este mic chiar fara tratament, iar eficienta apirinei pentru preventia primara a AVC ischemic raportata la riscul de sangerare nu a fost stabilita. (Nivel de evidenta C)
La pacientii cu FA care sufera un AVC ischemic sau un episod de embolie sistemica pe parcursul tratamentului anticoagulant de intensitate redusa (INR intre 2,0 si 3,0) este mai justificata cresterea intensitatii anticoagularii la un INR intre 3,0 si 3,5, decat adaugarea unui agent antiplachetar. (Nivel de evidenta C)
Anticoagularea pe termen lung cu un antagonist de vitamina K nu este recomandata pentru preventia primara a AVC la pacientii sub 60 de ani fara boala cardiaca (FA lone) si fara factori de risc pentru tromboembolism. (Nivel de evidenta C).
Administrarea de flecainida, dofetilid, propafenona sau ibutilid este recomandata pentru conversia farmacologica a FA. (Nivel de evidenta A)
Administrarea chinidinei sau procainamidei poate fi luata in considerare pentru conversia farmacologica a FA, insa utilitatea acestor agenti nu este bine stabilita. (Nivel de evidenta C)
Digoxinul si sotalolul pot fi riscante atunci cand sunt folosite pentru conversia FA si nu sunt recomandate. (Nivel de evidenta C)
Chinidina, procainamida, disopiramida si dofetilidul nu trebuie folosite in afara spitalului pentru conversia FA la ritm sinusal. (Nivel de evidenta B)
In conditiile in care frecventa ventriculara rapida nu poate fi controlata prompt cu masuri farmacologice la pacientii cu FA care au ischemie miocardica in evolutie, hipotensiune simptomatica, angina sau IC, conversia electrica imediata prin soc electric extern sincron cu unda R este recomandata. (Nivel de evidenta C)
Conversia electrica imediata este recomandata la pacientii cu FA si preexcitatie atunci cand frecventa ventriculara este foarte crescuta, sau cand apare instabilitate hemodinamica. (Nivel de evidenta B)
Conversia electrica este recomandata la pacientii fara instabilitate hemodinamica atunci cand simptomele date de FA sunt nu sunt tolerate de catre pacient. In cazul in care pacientul reintra in FA imediat dupa conversie, repetarea conversiei electrice se poate face dupa administrarea unui antiaritmic. (Nivel de evidenta C)
Conversia electrica poate fi folosita in vederea obtinerii ritmului sinusal ca parte a unei strategii pe termen lung la pacientii cu FA. (Nivel de evidenta B)
Este justificata luarea in considerare a preferintei pacientului atunci cand se opteaza pentru cardioversii repetate, rare, in managementul FA recurente sau simptomatice. (Nivel de evidenta C)
Repetarea frecventa a conversiei electrice nu este recomandata la pacientii care au perioade relativ scurte de ritm sinusal intre recaderile in FA, dupa mai multe incercari de conversie si in ciuda terapiei antiaritmice,. (Nivel de evidenta C)
Conversia electrica este contraindicata la pacientii cu toxicitate digitalica sau cu hipopotasemie. (Nivel de evidenta C)
Pretratamentul cu amiodarona, flecainida, ibutilid, propafenona sau sotalol poate fi folositor pentru a creste rata de succes a conversiei electrice si pentru preventia FA recurente. (Nivel de evidenta B)
La pacientii care reintra in FA dupa o conversie electrica reusita poate fi folositoare repetarea procedurii dupa administrarea profilactica de antiaritmice. (Nivel de evidenta C)
La pacientii cu FA persistenta administrarea de betablocante, disopiramida, diltiazem, dofetilid, procainamida sau verapamil poate fi luata in considerare, cu toate ca eficienta acestor agenti in cresterea ratei de succes a conversiei electrice sau in preventia recurentelor precoce de FA este neclara. (Nivel de evidenta C)
Initierea terapiei antiaritmice in afara spitalului in vederea facilitarii conversiei FA poate fi luata in considerare la pacientii fara boala cardiaca. (Nivel de evidenta C)
Initierea terapiei antiaritmice in afara spitalului in vederea facilitarii conversiei FA poate fi luata in considerare la pacientii cu anumite tipuri de boala cardiaca in conditiile in care siguranta medicamentului respectiv a fost verificata la pacientul in cauza. (Nivel de evidenta C)
Pentru pacientii cu FA de mai mult de 48 ore sau atunci cand vechimea FA nu este cunoscuta, anticoagularea orala (INR intre 2,0 si 3,0) este recomandata pentru cel putin 3 saptamani inainte si 4 saptamani dupa conversie, indiferent de metoda folosita pentru aceasta (electrica sau farmacologica). (Nivel de evidenta B)
La pacientii cu FA de mai mult de 48 ore care necesita conversie imediata datorita instabilitatii hemodinamice, heparina trebuie administrata concomitent (daca nu exista contraindicatii), initial in bolus urmat de o perfuzie continua in doza ajustata pentru a mentine timpul de tromboplastina partial activata de 1,5-2 ori mai mare decat normalul. Ulterior, anticoagularea orala (INR intre 2,0 si 3,0) trebuie mentinuta pentru cel putin 4 saptamani, in acelasi mod ca si pentru pacientii convertiti electiv. Exista putine date care sa sustina folosirea heparinei cu greutate moleculara mica pentru aceasta indicatie. (Nivel de evidenta C)
La pacientii cu FA cu durata mai mica de 24 de ore care asociaza instabilitate hemodinamica (angina pectorala, infarct miocardic, soc sau edem pulmonar) conversia trebuie efectuata imediat, fara initierea anticoagularii. (Nivel de evidenta C)
In primele 48 de ore dupa aparitia FA nevoia de anticoagulare inainte si dupa conversie poate fi evaluata in functie de riscul individual de tromboembolie al pacientului. (Nivel de evidenta C)
Ca si alternativa la anticoagulare inaintea conversiei FA, este rational sa se efectueze o ecocardiografie transesofagiana (ETE) in cautarea trombilor la nivelul atriului stang (AS) sau a urechiusei stangi (US). (Nivel de evidenta B)
(2a) La pacientii la care nu se indentifica tromb, este recomandata conversia imediat dupa anticoagulare cu heparina nefractionata (initiata cu bolus intravenos dupa care perfuzie continua in doza ajustata pentru mentinerea aPTT intre 1,5 si 2 ori valoarea de referinta, perfuzie mentinuta pana la stabilirea unei anticoagulari orale adecvate cu un antagonist de vitamina K (de ex. warfarina) controlata, cu un INR mai mare sau egal cu 2,0). (Nivel de evidenta B). Ulterior, anticoagularea orala (INR intre 2,0 si 3,0) se continua pentru o perioada de cel putin 4 saptamani, la fel ca pentru pacientii convertiti electiv. (Nivel de evidenta B). Exista putine date care sa sustina folosirea heparinei cu greutate moleculara mica pentru aceasta indicatie. (Nivel de evidenta C)
(2b) La pacientii la care ETE identifica tromb este recomandabila anticoagularea orala (INR intre 2,0 si 3,0) pentru cel putin 3 saptamani inainte si 4 saptamani dupa restaurarea ritmului sinusal. Poate fi necesara o perioada de anticoagulare chiar mai prelungita dupa o conversie reusita datorita faptului ca riscul de tromboembolie deseori se mentine ridicat in asemenea cazuri. (Nivel de evidenta C)
La pacientii cu flutter atrial care urmeaza a fi convertiti anticoagularea poate fi folositoare in aceleasi conditii ca si pentru pacientii cu FA. (Nivel de evidenta C)
Inainte de initierea terapiei antiaritmice se recomanda tratamentul factorilor precipitanti si a cauzelor reversibile. (Nivel de evidenta C)
Tratamentul farmacologic poate fi folositor la pacientii cu FA pentru mentinerea ritmului sinusal si prevenirea aparitiei tahicardiomiopatiei. (Nivel de evidenta C)
Aparitia unor episoade de FA mai rare si bine tolerate poate fi considerat un rezultat acceptabil pentru o medicatie antiaritmica. (Nivel de evidenta C)
Initierea tratamentului antiaritmic in afara spitalului este acceptabila la pacientii cu FA fara boala cardiaca atunci cand medicamentul este bine tolerat. (Nivel de evidenta C)
La pacientii cu FA lone fara boala cardiaca structurala, initierea propafenonei sau flecainidei in afara spitalului poate fi benefica la cei cu FA paroxistica care sunt in ritm sinusal in momentul in momentul initierii tratamentului. (Nivel de evidenta B)
Sotalolul poate fi benefic la pacientii nespitalizati, in ritm sinusal, fara boala cardiaca, predispusi la la FA paroxistica, daca intervalul QT de baza necorectat este mai mic de 460msec, electrolitii serici sunt in limite normale si pacientul nu are factori de risc pentru proaritmia asociata antiaritmicelor de clasa III. (Nivel de evidenta C)
Ablatia prin cateter este o alternativa acceptabila la terapia farmacologica pentru preventia recurentelor FA la pacientii simptomatici cu atriu stang normal sau putin dilatat. (Nivel de evidenta C)
Terapia antiaritmica cu un anumit medicament in vederea mentinerii ritmului sinusal nu este recomandata la pacientii care au factori de risc clar identificati pentru proaritmie cu respectivul drog. (Nivel de evidenta A)
Terapia farmacologica pentru mentinerea ritmului sinusal nu este recomandata la pacientii cu boala de nod sinusal avansata sau la cei cu disfunctie de nod atroventricular (AV) cu exceptia celor care au un pacemaker functional. (Nivel de evidenta C)
Terapia orala cu betablocante in vederea preventiei FA postoperatorii este recomandata la pacientii care sunt supusi unei interventii chirurgicale cardiace, daca nu exista contraindicatii. (Nivel de evidenta A)
Administrarea de blocante ale nodului AV este recomandata pentru obtinerea controlului frecventei ventriculare la pacientii la care apare FA postoperatorie. (Nivel de evidenta B)
Administrarea preoperatorie de amiodarona reduce incidenta FA la pacientii care sufera o interventie chirurgicala cardiaca si reprezinta o terapie profilactica adecvata pentru pacientii cu risc crescut pentru FA postoperatorie. (Nivel de evidenta A)
Este acceptabil sa se converteasca FA postoperatorie fie farmacologic cu ibutilid, fie electric, cu aceleasi indicatii ca si pentru pacientii non-chirurgicali. (Nivel de evidenta B)
Este justificata administrarea terapiei antiaritmice pentru mentinerea ritmului sinusal la pacientii cu FA postoperatorie recurenta sau refractara la tratament in acelasi mod ca si pentru pacientii non-chirurgicali. (Nivel de evidenta B)
Este recomandabil sa se administreze terapie antirombotica la pacientii cu FA postoperatorie in acelasi mod ca si pentru pacientii non-chirurgicali. (Nivel de evidenta B)
Administrarea profilactica de sotalol poate fi luata in considerare la pacientii la risc pentru a dezvolta FA dupa chirurgie cardiaca. (Nivel de evidenta B)
Conversia electrica este recomandata la pacientii cu FA si infarct miocardic acut (IMA) la care starea hemodinamica este sever alterata, sau au ischemie necontrolabila, sau la care frecventa ventriculara nu poate fi controlata cu agenti farmacologici. (Nivel de evidenta C)
Administrarea intravenoasa de amiodarona este recomandata pentru controlul frecventei ventriculare si pentru ameliorarea functiei VS la pacientii cu FA si IMA. (Nivel de evidenta C)
Administrarea intravenoasa de betablocante sau blocante de calciu nondihidropiridinice este recomandata pentru scaderea frecventei ventriculare la pacientii cu FA si IMA care nu prezinta semne de disfunctie de VS, bronhospasm sau bloc AV. (Nivel de evidenta C)
La pacientii cu FA si IMA se recomanda administrarea heparinei nefractionate fie in perfuzie endovenoasa continua, fie subcutanat, in doza adecvata pentru prelungirea aPTT de 1,5 pana la 2 ori valoarea de referinta, cu exceptia cazurilor in care exista contraindicatii. (Nivel de evidenta C)
Administrarea intravenoasa de digitala la pacientii cu FA si IMA cu disfunctie severa de VS si IC este justificata in vederea scaderii frecventei ventriculare rapide si pentru ameliorarea functiei VS. (Nivel de evidenta C)
Administrarea unui antiaritmic de clasa IC nu este recomandata la pacientii cu FA si IMA. (Nivel de evidenta C)
Ablatia prin cateter a caii accesorii este recomandata pacientilor simptomatici cu FA care au sindromul WPW, si mai ales celor care prezinta sincope ca urmare a frecventei ventriculare rapide, sau celor care au un fascicul accesor cu perioada refractara scurta. (Nivel de evidenta B)
Conversia electrica imediata este recomandata cu scopul de a preveni fibrilatia ventriculara la pacientii cu tract accesor anterograd cu perioada refractara scurta, la care FA cu frecventa ventriculara rapida este asociata cu instabilitate hemodinamica. (Nivel de evidenta B)
Procainamida intravenos sau ibutilidul sunt recomandate pentru conversia la ritm sinusal la pacientii cu WPW stabili hemodinamic la care FA se asociaza cu aspect ECG de complex QRS larg (cu durata egala sau mai mare de 120msec) sau cu raspuns ventricular preexcitat rapid. (Nivel de evidenta C)
Flecainida intravenos sau conversia electrica sunt justificata la pacientii cu raspuns ventricular foarte rapid si FA cu conducere pe cale accesorie. (Nivel de evidenta B)
Este justificata administrarea intravenoasa de chinidina, procainamida, disopiramida, ibutilid sau amiodarona la pacientii stabili hemodinamic cu FA si conducere pe cale accesorie. (Nivel de evidenta B)
Administrarea intravenoasa de digoxin sau antagonisti de canal calcic non-dihidropiridinic nu este recomandata la pacientii cu sindrom WPW care au FA si conducere pe calea accesorie. (Nivel de evidenta B)
Administrarea de betablocant pentru controlul frecventei ventriculare este recomandata la pacientii cu FA si tireotoxicoza, daca nu au contraindicatii. (Nivel de evidenta B)
In cazurile in care nu se poate administra un betablocant, folosirea unui blocant de canal calcic nondihidropiridinic (verapamil sau diltiazem) este recomandata in vederea controlului frecventei ventriculare la pacientii cu FA si tireotoxicoza. (Nivel de evidenta B)
La pacientii cu FA asociata tireotoxicozei, anticoagularea orala (INR intre 2,0 si 3,0) este recomandata pentru preventia AVC ischemic in acelasi mod ca si pentru pacientii cu FA si alti factori de risc tromboembolic. (Nivel de evidenta C)
Dupa restabilirea statusului eutiroidian, recomandarile privind profilaxia antitrombotica sunt aceleasi ca si pentru pacientii fara hipertiroidism. (Nivel de evidenta C)
Administrarea de digoxin, betablocant sau blocant de canal calcic non-dihidropiridinic pentru controlul frecventei ventriculare este recomandata la pacientele gravide cu FA. (Nivel de evidenta C)
Conversia electrica e recomandata la pacientele gravide care sunt instabile hemodinamic datorita FA. (Nivel de evidenta C)
Profilaxia antitromotica este recomandata in timpul sarcinii la toate pacientele cu FA (cu exceptia celor cu FA lone sau cu risc tromboembolic scazut). Tipul terapiei (anticoagulant sau aspirina) trebuie ales in functie de varsta sarcinii. (Nivel de evidenta C)
Administrarea de heparina in primul trimestru si in ultima luna de sarcina poate fi luata in considerare la pacientele cu FA si factori de risc pentru tromboembolism. Heparina nefractionata poate fi administrata fie in perfuzie intravenoasa continua in doza ajustata pentru mentinerea aPTT intre 1,5 si de 2 ori valoarea de referinta, fie prin multiple injectii subcutanate in doza de 10000 pana la 20000U la 12 ore cu control al aPTT (la 6 ore dupa injectie) astfel incat acesta sa fie de 1,5 ori peste valoarea de referinta. (Nivel de evidenta B)
In ciuda lipsei de date care sa sustina aceasta indicatie, administrarea subcutanata de heparina cu greutate moleculara mica poate fi luata in considerare in primul trimestru si ultima luna de sarcina la pacientele cu FA si factori de risc pentru tromboembolism. (Nivel de evidenta C)
Administrarea unui anticoagulant oral poate fi luata in considerare in timpul celui de-al doilea trimestru de sarcina la pacientele cu FA si risc tromboembolic inalt. (Nivel de evidenta C)
Administrarea de chinidina sau procainamida poate fi luata in considerare in vederea conversiei farmacologice la pacientele cu FA hemodinamic stabile. (Nivel de evidenta C)
Anticoagularea orala (INR intre 2,0 si 3,0) este recomandata la pacientii cu FA si CMH in acelasi mod ca si pentru alti pacienti cu risc crescut de tromboembolism. (Nivel de evidenta B)
Tratamentul antiaritmic poate fi util pentru preventia FA recurente la pacientii cu CMH. Nu exista suficiente date care sa recomande un anumit medicament in defavoarea celorlalte, insa sunt de preferat fie combinatia intre disopiramida si un betablocant sau blocant de canal calcic non-dihidropiridinic, fie amiodarona singura. (Nivel de evidenta C)
Corectarea hipoxemiei si a acidozei este prima masura terapeutica recomandata la pacientii care dezvolta FA in cursul unei boli pulmonare acute sau in cursul unei exacerbari a unei boli pulmonare cronice. (Nivel de evidenta C)
Un blocant de canal calcic non-dihidropiridinic (diltiazem sau verapamil) este recomandat pentru controlul frecventei ventriculare la pacientii cu FA si boala pulmonara obstructiva. (Nivel de evidenta C)
La pacientii cu boala pulmonara care devin instabili hemodinamic datorita FA se recomanda incercarea conversiei electrice. (Nivel de evidenta C)
Teofilina si beta agonistii adrenergici nu sunt recomandati la pacientii cu boala pulmonara bronhospastica care au si FA. (Nivel de evidenta C)
Betablocantele, sotalolul, propafenona si adenozina nu sunt recomandate la pacientii cu boala pulmonara obstructiva care au si FA. (Nivel de evidenta C)
Fibrilatia atriala este o tahiaritmie supraventriculara caracterizata prin activare atriala necoordonata si, implicit, prin deteriorarea functiei mecanice atriale. Aspectul ECG este de oscilatii rapide sau unde de fibrilatie care variaza ca frecventa, amplitudine si aspect si inlocuiesc succesiunea constanta de unde P. Deasemenea se remarca raspunsul ventricular neregulat si rapid atunci cand conducerea AV este intacta1. Frecventa ventriculara depinde de proprietatile electrofiziologice ale nodului AV si ale celorlalte tesuturi de conducere, de tonusul simpatic si vagal, de prezenta sau absenta tractelor accesorii si de actinea unor medicamente2. Cand apar blocul AV sau tahicardia jonctionala ciclurile cardiace (intervalele R-R) pot fi regulate. La pacientii cu pacemaker diagnosticul FA poate necesita inhibitia acestuia pentru a se putea vizualiza undele de fibrilatie. O tahicardie cu complex QRS larg care este sustinuta si neregulata sugereaza FA cu conducere pe cale accesorie sau FA cu bloc de ramura. Flutterul atrial este de regula usor de deosebit de fibrilatia atriala. Frecvente ventriculare extrem de rapide (mai mari de 200/minut) sugereaza prezenta unei cai accesorii sau tahicardie ventriculara.
FA poate aparea in asociatie cu flutterul atrial sau cu tahicardia atriala. Forma tipica de flutter atrial se caracterizeaza printr-un aspect ECG de activare atriala regulata, in dinti de fierastrau, undele care apar fiind denumite unde de flutter (f). Acestea sunt vizibile in special in derivatiile II, III, aVF si V1. La pacientii netratati frecventa atriala este in mod tipic intre 240 si 320/min, cu unde f negative in derivatiile II, III si aVF si pozitive in V1. Sensul circuitului de depolarizare din atriul drept (AD) poate fi inversat, acest lucru rezultand in unde f pozitive in derivatiile II, III, aVF si negative in V1. Flutterul atrial poate degenera in FA, iar aceasta poate trece in flutter atrial. Flutterul atrial este de obicei usor de deosebit de FA dar pot apare greseli de diagnostic atunci cand se observa unde de fibrilatie proeminente in mai mult de o derivatie ECG.
Tahicardiile atriale focale, tahicardiile atrioventriculare reintrante precum si tahicardia AV nodala reintranta pot declansa FA. In aceste tahicardii, in mod tipic exista unde P separate de linie izoelectrica iar morfologia lor poate fi de folos in localizarea aritmiei.
Au fost propuse mai multe sisteme de clasificare a fibrilatiei atriale(FA), bazate pe aspectul ECG1, inregistrarea epicardica4 sau endocavitara, mapping-ul activitatii electrice atriale sau caracterele clinice. Desi aspectul ECG poate varia in timp, acesta poate fi util pentru caracterizarea aritmiei la un momet dat. Schema de clasificare recomandata aici reprezimta un consens rezultat din dorinta ca aceasta sa fie cat mai simpla si mai relevanta clinic.
Clinicianul trebuie sa recunoasca primul episod detectat de FA, simptomatic sau nu, auto-limitat sau nu, si sa admita existenta unei incertitudini privind durata reala a episodului si existenta sau nu a altor episoade anterioare (ura 1). Dupa 2 sau mai multe episoade, FA este considerata recurenta. Atunci cand aritmia se termina spontan, FA recurenta este numita paroxistica; atunci cand aritmia persista mai mult de 7 zile, este denumita persistenta. Rezolvarea prin terapie farmacologica sau prin cardioversie nu modifica modalitatea de denumire. FA detectata initial poate fi paroxistica sau persistenta. Categoria FA persistenta include si cazurile de FA de lunga durata (de ex. mai lunga de 1 an), care de obicei conduc la FA permanenta la care cardioversia a esuat sau a fost amanata.
ura 1. Tipurile de fibrilatie atriala (FA). 1, episoade care dureaza im general 7 zile sau mai putin (majoritatea mai putin de 24 ore); 2, episoade care dureaza in general mai mult de 7 zile; 3, cardioversie esuata sau neincercata; 4, atat FA paroxistica, cat si cea persistenta pot fi recurente
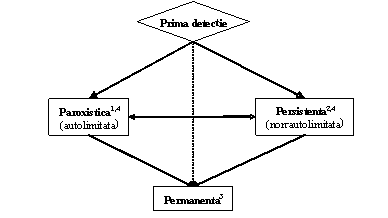

Aceste catgorii nu se exclud reciproc astfel ca un anume pacient poate avea mai multe episoade de FA paroxistica si ocazional FA persistenta sau inversul; totusi in practica se include pacientul intr-o categorie sau alta in functie de tipul cel mai frecvent de prezentare. Definitia FA permanente este adesea arbitrara si durata se refera atat la episoadele individuale cat si la perioada de timp scursa de la momentul diagnosticului de FA. Astfel, la un pacient cu FA paroxistica, pot apare episoade cu durata de secunde sau ore, in mod repetat timp de ani de zile.
Aceasta terminologie se aplica episoadelor cu durata mai mare de 30 de secunde ce nu au o cauza reversibila. FA secundara IM, chirurgiei cardiace, pericarditei, miocarditei, hipertiroidiei sau unei boli pulmonare acute sunt considerate separat. In aceste situatii, FA nu este problema primordiala si tratamentul bolii asociate rezolva de obicei si aritmia. Pe de alta parte, atunci cand FA apare in contextul unei boli concomitente cum ar fi hipotiroidia bine controlata, se aplica principiile generale de tratament al acestei aritmii.
Termenul FA izolata se aplica indivizilor mai tineri de 60 de ani care nu au do clinice sau ecocardiografice de boala cardiopulmonara, inclusiv hipertensiune5. Acesti indivizi au prognostic favorabil, in ceea ce priveste riscul tromboembolic si mortalitatea. In timp, pacientii ies din categoria FA izolate datorita imbatranirii sau aparitiei anomaliilor cardiace (cum ar fi dilatarea AS), situatie in care riscurile mentionate anterior cresc. Termenul FA non-valvulara se refera la acele cazuri ce nu au valvulopatie mitrala postreumatismala, proteza valvulara sau reconstructie valvulara.
FA este cea mai frecventa aritmie intalnita in practica medicala, fiind responsabila de aproximativ o treime din spitalizarile pentru tulburare de ritm cardiac. Se apreciaza ca 2,3 milioane de oameni din America de Nord si 4,5 milioane de oameni din Uniunea Europeana au FA paroxistica sau persistenta9. In ultimii 20 de ani numarul internarilor pentru FA a crescut cu 66%7 datorita imbatranirii populatiei, cresterii prevalentei bolilor cardiace cronice, stabilirii mai frecvente a acestui diagnostic datorita folosirii dispozitivelor de monitorizare ambulatorie si altor factori. FA este o problema de sanatate publica extrem de costisitoare (aproximativ 3000 [aproximativ 3600$ US] anual per pacient)8; in Uniunea Europeana, costul total se apropie de 13,5 mld (aproximativ 15,7 mld $ US).
Prevalenta estimata a FA in populatia generala este 0,4-l%9 si creste cu varsta pana la 8% la persoanele peste 80 de ani10. La femei prevalenta ajustata cu varsta a ramas constanta de-a lungul ultimei generatii11, in timp ce la barbati s-a dublat10. Varsta medie a pacientilor cu FA este in jur de 75 de ani. Proportia pe sexe a pacientilor cu FA este aproximativ egala, dar circa 60% din cei peste 75 de ani sunt femei. Pe baza datelor limitate existente in prezent, se pare ca riscul ajustat cu varsta de a dezvolta FA la populatia de culoare, este mai mic de jumatate fata de populatia alba.
In studiile populationale, pacientii care nu au istoric de boala cardiopulmonara reprezinta mai putin de 12% din toate cazurile de FA10. Cu toate acestea, in serii de cazuri, proportia cazurilor de FA izolata a fost uneori mai mare de 30%12.
In studiile prospective, incidenta FA creste de la sub 0,1% la persoane mai tinere de 40 de ani la mai mult de 1,5% la femeile peste 80 de ani respectiv 2% la barbatii peste 80 ani13. La pacientii tratati pentru IC incidenta pe 3 ani a FA a fost aproape 10%14. Inhibarea angiotensinei pare ca se asociaza cu o reducere a incidentei FA la pacientii cu IC15 si hipertensiune16.
FA se asociaza cu cresterea pe termen lung a riscului de infarct cerebral17, IC si mortalitate de toate cauzele, in special la femei.18 Rata mortalitatii pacientilor cu FA este dubla fata de cea a pacientilor aflati in ritm sinusal normal si este legata de severitatea bolii cardiace subiacente.19 In studiul ALFA, circa doua treimi din mortalitatea anualizata de 5% constatata a fost datorata cauzelor cardiovasculare.12 In studiile mari referitoare la IC (COMET, Val-HeFT), FA a fost un factor independent de risc pentru mortalitate si morbiditate.20,21 IC favorizeaza aparitia FA, FA agraveaza IC astfel ca indivizii care au una dintre boli si o dezvolta si pe cealalta au prognostic mai prost.22 De aceea, ingrijirea unui pacient cu aceste doua suferinte este o adevarata provocare. In plus, este nevoie de studii clinice randomizate care sa cerceteze impactul FA asupra prognosticului IC.
Frecventa accidentului vascular cerebral ischemic la pacientii cu FA de etiologie non-valvulara este de 5% pe an, adica de 2 pana la 7 ori mai mare ca a celor fara FA.23 Unul din 6 accidente vasculare cerebrale ischemice apare la un pacienti cu FA, in timp ce, daca se iau in considerare si AIT-urile precum si infarctele cerebrale silentioase decelate doar imagistic, frecventa ischemiei cerebrale asociata FA non-valvulare depaseste 7% pe an.24 Pacientii cu valvulopatie post-reumatismala si FA din studiul Framingham au avut un risc de infarct cerbral de 17 ori mai mare fata de subiectii de aceeasi varsta din lotul martor, iar riscul atribuibil a fost de 5 ori mai mare fata de pacientii cu FA non-reumatismala.23 In plus, riscul de infarct cerebral a crescut cu varsta; riscul anual atribuibil FA a fost de 1,5% la indivizii cu varsta cuprinsa intre 50 si59 de ani si de 23,5% la cei cu varsta cuprinsa intre 80 si 89 de ani.23
Cele mai frecvente modificari histopatologice intalnite in FA sunt fibroza atriala si pierderea masei musculare atriale; totusi este dificil de diferentiat intre modificarile datorate FA si cele datorate bolii cardiace asociate. Fibroza atriala poate precede debutul FA,26 si alaturarea zonelor de fibroza parcelara cu fibre atriale normale poate fi raspunzatoare de neomogenitatea conducerii.27 Fibroza interstitiala poate fi rezultatul apoptozei ce duce la inlocuirea miocitelor atriale,28 pierderea miofibrilelor, acumularea de granule de glicogen, perturbarea cuplajului celulelor la nivelul jonctiunilor intercelulare (gap junctions),29 si agregarea organitelor celulare.30 De asemenea ea poate fi declansata de dilatatia atriala care se produce in orice tip de boala cardiaca asociata cu FA.
Pacientii cu valvulopatie care au fibroza usoara raspund mai bine la cardioversie fata de cei cu fibroza severa si se considera ca fibroza contribuie la persistenta FA.31 S-a descris dublarea concentratiei glicoproteinelor membranare care controleaza interactiunile celula-celula respectiv celula-matrice intercelulara (desintegrina si metaloproteinazele) la nivelul miocardului uman in cursul FA. Aceste modificari pot contribui la dilatatia atriala a pacientilor cu FA indelungata. Dilatarea atriilor activeaza mai multe cai moleculare printe care si sistemul renina-angiotensina-aldosteron (SRAA). Ca raspuns la intindere se produce stimularea angiotensinei II.32 In tesutul atrial al pacientilor cu FA persistenta se constata cresterea expresiei enzimei de conversie a angiotensinei (ECA).33 Inhibarea angiotensinei poate preveni FA prin reducerea fibrozei.34 Dilatatia atriala si fibroza interstitiala din IC faciliteaza FA sustinuta.35 Linistea electrica regionala (ce sugereaza cicatrice), reducerea voltajului si incetinirea conducerii descrise la pacientii cu IC sunt similare modificarilor atriale care apar ca o consecinta a imbatranirii.36
Datele disponibile in prezent sustin ipoteza unui mecanism declansator focal ce implica automatismul sau multiple circuite de reintrare, insa aceste mecanisme nu se exclud reciproc si pot coexista (ura 2).
ura 2. Vedere posterioara a principalelor mecanisme electrofiziologice ale fibrilatiei atriale. (A) Activare focala. Focarul initiator (indicat prin steluta) se gaseste adesea in regiunea venelor pulmonare. Circuitele care rezulta reprezinta conducere fibrilatorie la fel ca in situatia reintrarii prin circuite multiple. (B) Reintrarea prin circuite multiple. Circuitele (indicate prin sageti) reintra la intamplare in tesut activat anterior de acelasi circuit sau de un altul. Caile pe care se deplaseaza circuitele variaza. Reprodus cu permisiune dupa Konnigs KT, Kirchhof CJ, Smeets JR, et al. High-density mapping of electrically induced atrial fibrillation in humans. Circulation 1994;89:1665-l68045. AS indica atriu stang; VP, vene pulmonare; VCI, vena cava inferioara; VCS, vena cava superioara; AD, atriu drept.
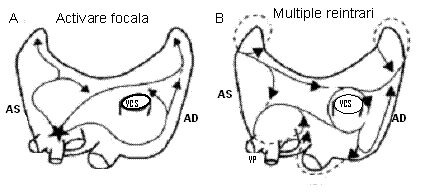
Originea focala a FA este sustinuta de faptul ca s-a putut identifica o sursa focala a FA a carei ablatie a determinat incetarea FA.37 Desi VP sunt sursa cea mai frecventa a acestor impulsuri atriale rapide, s-au identificat focare si la nivelul VCS, ligamentului lui Marshall, peretelui posterior liber al VS, cristei terminalis si sinusului coronar.37-40 In studii histologice, muschiul cardiac cu proprietati electrice conservate se extinde in VP,41 iar evidentierea VP drept declansatori principali ai FA a determinat cercetarea substantiala a proprietatilor anatomice si electrofiziologice ale acestor structuri. Tesutul atrial din VP ale pacientilor cu FA are perioade refractare mai scurte decat la pacientii martori sau decat in alte regiuni ale atriilor pacinetilor cu FA.42,43 Aceasta heterogenitate de conducere poate promova reintrarea si poate constitui substratul FA sustinute.44
Ipoteza circuitelor multiple ca mecanism al FA prin reintrare46 implica ruperea frontului de unde care se propaga prin atrii si auto-perpetuarea undelor fiice. In acest model, numarul de unde in orice moment depinde de masa, perioada refractara si viteza conducerii in diverse parti ale atriilor. O masa atriala mare cu perioada refractara scurta si conducere intarziata creste numarul de circuite, favorizand astfel FA sustinuta. Ipoteza circuitelor multiple a fost sustinuta de inregistrarea simultana la om a curentilor de la mai multi electrozi.47 Desi ipoteza circuitelor multiple a fost multi ani teoria dominanta care explica mecanismele producerii FA, date provenind din studii de mapping, experimentale47a si clinice47b,47c, vin sa o puna la indoiala. Distributia cat mai larga a electrogramelor anormale in AD prezice aparitia FA persistente la pacientii cu FA paroxistica idiopatica,48 ceea ce sugereaza impotanta unui substrat anormal pentru mentinerea FA. Mai mult, la pacientii cu FA persistenta care se convertesc la ritm sinusal, conducerea intra-atriala este prelungita comparativ cu un grup de control, in special la cei care au FA recurenta.49 La pacientii cu IC predispusi la FA paroxistica, s-a constatat mai frecvent prelungirea undei P la analiza signal avereged ECG 50 Deoarece aceste observatii au fost descrise inaintea debutului clinic al FA, ele nu pot fi atribuite remodelarii atriale ce apare ca o consecinta a FA si, ca atare, nu se cunoaste gradul in care modificarile arhitecturii atriale contribuie la initierea si mentinerea FA.
Cardioversia electrica sau farmacologica a FA are succes maxim atunci cand FA dureazp de mai putin de 24 de ore,51 in timp ce cresterea duratei FA face restabilirea si mentinerea ritmului sinusal mai putin probabila. Aceste observatii au dat nastere aprecierii FA intretine FA. Ideea ca FA se auto-intretine capata suport experimental de la un model pe capra ce utilizeaza un fibrilator atrial automat care detecteaza terminarea spontana a FA si reinduce aritmia prin stimulare electrica.52 Initial FA indusa electric se termina spontan. Dupa induceri repetate insa, episoadele devin to mai sustinute pana ce FA persista la o frecventa atriala mai repida.52 Predispozitia crescanda pentru FA este legata de scurtarea progresiva a perioadei refractare efective, cu cresterea duratei episoadelor. Acest fenomen este cunoscut drept remodelare electrofiziologica.
Pe langa remodelare si modificari ale perioadei refractare, FA prelungita perturba functia contractila atriala. Dupa o perioada de FA persistenta, recuperarea contractilitatii atriale poate fi intarziata cu zile sau saptamani fata de momentul restaurarii ritmului sinusal; aceasta are implicatii importante asupra duratei anticoagularii dupa cardioversie. (Vezi Sectiunea VIII.B.2, Prevenirea trombembolismului.)
Tot mai multe date arata importanta SRAA in geneza FA.53 Administrarea de irbesartan si amiodarona s-a asociat cu o incidenta mai mica a recidivei FA dupa cardioversie ativ cu administrarea doar a amiodaronei,15 iar tratamentul cu inhibitori ai angiotensinei si diuretica redus incidenta FA dupa abaltia prin cateterism a flutterului atrial.54 Inhibitia SRAA, singura sau in combinatie cu alte terapii, poate preveni instalarea sau mentinerea FA prin mai multe mecanisme,55 printre care: diminuarea stressului parietal, prevenirea remodelarii structurale (fibroza, dilatare, hipertrofie), atat in AS cat si in VS, inhibitia activarii neuro-umorale, reducerea tensiunii arteriale, prevenirea sau ameliorarea IC, evitarea hipopotasemiei. Tratamentul cu trandolapril a redus incidenta FA la pacientii cu disfunctie a VS post-IM acut,56 insa nu se stie daca acest efect este consecinta impiedicarii remodelarii structurale sau electrice a atriilor sau a unui alt mecanism.
In Tabelul 2 sunt aratati alti factori potential implicati in inducerea si mentinerea FA. Printre acesia se numara inflamatia, in prezent existand studii in desfasurare care cerceteaza utilitatea medicatiei de tip statine in legatura cu acest mecanism.
Tabelul 2 Etiologii si factori predispozanti pentru FA
|
Anomalii electrofiziologice |
|
Cresterea automatismului (FA focala) Anomalii de conducere (reintrare) |
|
Cresterea presiunii atriale |
|
Valvulopatie mitrala sau tricuspidiana Boala miocardica (primara sau secundara, ducand la disfuntie sistolica sau diastolica) Anomalii valvulare semilunare (producand hipertrofie ventriculara) Hipertensiune sistemica sau pulmonara (embolie pulmonara) |
|
Ischemie atriala |
|
Boala coronariana ischemica |
|
Boala atriala inflamatorie sau infiltrativa |
|
Pericardita Amiloidoza Miocardita Modificari fibrotice atriale induse de varsta |
|
Substante toxice |
|
Alcoolul Cafeina |
|
Tulburari endocrine |
|
Hipertiroidia Feocromocitomul |
|
Modificari ale tonusului vegetativ |
|
Cresterea activitatii parasimpatice Cresterea activitatii simpatice |
|
Tumora primara sau metastatica in sau adiacent de peretele atrial |
|
Postoperator |
|
Cardiac, pulmonar sau esofagian |
|
Cardiopatie congenitala |
|
Neurogen |
|
Hemoragie subarahnoidiana AVC major, non-hemoragic |
|
Idiopatic (FA izolata-lone) |
|
FA familiala |
FA indica fibrilatie atriala
In absenta unei cai accesorii sau a disfunctiei sistemului His-Purkinje, nodul AV este cel care limiteaza conducerea in cursul FA.57 Dintre multiplelel impulsuri atriale ce ajung la nodul AV, 2 par a fi dominante : unul directionat posterior via crista terminalis si celalat directionat anterior via septul interatrial. Alti factori ce afecteaza conducerea AV sunt perioada refractara intrinseca a nodului AV, conducerea ascunsa (concealed) si tonusul vegetataiv. Conducerea ascunsa joaca un rol important in determinarea raspunsului ventricular in timpul FA58 prin perturbarea refractaritatii nodului AV si prin incetinirea sau blocarea impulsurilor atriale, si poate explica neregularitatea raspunsului ventricular in timpul FA.59 Atunci cand frecventa atriala in cursul FA este relativ scazuta, frecventa ventriculara tinde sa creasca si, invers, frecvente atriale mai mari se asociaza cu raspunsuri ventriculare mai mici.
Scaderea tonusului simpatic si cresterea celui parasimpatic exercita efecte dromotrop negative asupra conducerii nodului AV, in timp ce si opusul este valabil in situatia cresterii tonusului simpatic si a scaderii celui parasimpatic.58 Tonusul vagal creste de asemenea efectele cronotrop negative ale conducerii ascunse la nivelul nodului AV.60 Fluctuatiile tonusului vegetativ pot determina, in cursul FA, raspunsuri ventriculare variate, situatie exemplificata de scaderea frecventei ventriculare in timpul somnului si accelerarea ei in timpul exercitiului fizic. Digitala, care scade frecventa ventriculara in FA in principal prin cresterea tonusului vagal, este astfel mai eficienta pentru controlul frecventei cardiace in repaus decat in timpul exercitiului fizic.
Conducerea de-a lungul unei cai accesorii in FA poate determina frecvente ventriculare periculos de rapide.2 Transformarea reintrarii AV in FA la pacienti cu sindrom WPW poate produce raspuns ventricular rapid care degenereaza in fibrilatie ventriculara letala.61 Medicamentele care lungesc perioada refractara si scad conducerea la nivelul nodului AV ( cum ar fi digitala, verapamilul, sau diltiazamul) nu blocheaza conducerea pe calea accesorie si astfel pot accelera frecventa ventriculara. De aceea aceste medicamente sunt contraindicate in aceasta situatie.62 Cu toate ca potentialul beta-blocantelor de a accentua conducerea pe calea accesorie este controversat, se recomanda prudenta in folosirea acestor medicamente la pacientul cu FA si preexcitatie.
Printre factorii care afecteaza functia hemodinamica in FA se numara pierderea sincronizarii activitatii mecanice atriale, raspunsul ventricular neregulat, frecventa cardiaca rapida si alterarea fluxului sanghin coronarian. Pierderea contractilitatii atriale poate scadea marcat debitul cardiac, mai ales atunci cand umplerea ventriculara diastolica este perturbata de stenoza mitrala, hipertensiune, CMH sau cardiomiopatie restrictiva. Contractilitatea miocardica nu este constanta in timpul FA datorita relatiei forta-interval asociata in acest caz cu variatii ale lungimii ciclului cardiac.63 La pacientii cu FA persistenta, volumele medii al AS si VS cresc in timp64 si restabilirea si mentinerea ritmului sinusal scad aceste volume.65 Mai mult, TEE a aratat faptul ca functia contractila si viteza fluxului sanghin in auriculul stang se restabilesc dupa cardioversie, ceea ce vine sa confirme existenta unei cardiomiopatii atriale reversibile la pacientii cu FA.66 Desi ne-am astepta ca restabilirea ritmului sinusal sa amelioreze si celelalte caracteristici hemodinamice asociate cu FA, aceasta nu se intampla intotdeauna67.
Dincolo de efectele asupra functiei atriale, persistenta in cursul FA a unei frecvente ventriculare crescute poate creste regurgitarea mitrala si poate produce cardiomiopatie cu dilatare ventriculara (tahicardiomiopatie).2,68 Este important ca aceasta cauza de cardiomiopatie, in care IC este mai degraba consecinta decat cauza a FA, sa fie recunoscuta deoarece controlul frecventei ventriculare poate duce la inversarea procesului miopatic. Pentru explicarea cardiomiopatiei induse de tahicardie au fost propuse mai multe teorii printre care depletia de energie a miocardului, ischemia, reglarea anormala a calciului si remodelarea, insa mecanismele certe ramin inca neclare69.
Desi accidentul vascular cerebral (AVC) ischemic si ocluzia arteriala sistemica in FA sunt de obcei atribuite emboliei provenita din trombusul din VS, patogenia trombemboliei este complexa.70
Pana la 25% din AVC ale pacientilor cu FA pot fi datorate unor boli cerebrovasculare intrinseci, altor surse de embolizare sau patologiei ateromatozice din aorta proximala.71,72 Riscul anual de AVC la pacientii cu FA este intre 3 si 8% pe an, in functie de factorii de risc pentru AVC asociati.23 Aproximativ jumatate din varstnicii cu FA au si HTA (factor major de risc pentru boala cerebrovasculara) si aproximativ 12% au si stenoza cariotidiana.73 Totusi, ateroscleroza carotidiana nu este semnificativ mai prevalenta la pacientii cu AVC si FA fata de cei fara FA si probabil ca este un factor epidemiologic relativ minor74.
Sursa principala de AVC ischemic cardioembolic la pacientul cu FA este considerata a fi formarea de trombi ca urmare a stazei din auriculul drept. Acesti trombi nu pot fi examinati intotdeauna prin ecocardiografie transtoracica,75 si TEE este o metoda mai sensibila si specifica pentru a aprecia funtia auriculului drept76 si a detecta formarea trombilor. Studii de TEE ale AS77 si auriculului stang78 seriate, efectuate in timpul conversiei FA la ritm sinusal au aratat reducerea vitezei fluxului in auriculul stang datorita pierderii organizarii contractiei mecanice in timpul FA. Trombii se intalnesc mai frecvent la pacientii cu FA si AVC ischemic decat la cei cu FA dar fara infarct cerebral.79 Desi ingrijirea acestor pacienti se bazeaza pe presupunurea ca formarea trombului necesita prezenta FA pentru minim 48 de ore, TEE a vizualizat trombi si la intervale de timp mai mici.80,81
Dupa cardioversia reusita, indiferent de metoda folosita (electrica, farmacologica sau spontana),82 inghetareaauriculului stang poate fi cauza cresterii riscului evenimentelor tromboembolice. Acest fenomen are un maximum imediat dupa cardioversie; ameliorarea progresiva a functiei atriale se produce de obicei in cateva zile, dar uneori poate dura 3-4 saptamani, in functie de durata FA.82,83 Aceasta este in concordanta cu faptul ca peste 80% din evenimentele tromboembolice de dupa cardioversie, se petrec in primele 3 zile si aproape toate in primele 10 zile.84 Studiile de TEE au aratat disparitia trombilor la majoritatea pacientilor.85 Observatii similare au permis aprecierea caracterului dinamic al disfuntiei AS/auriculului stang dupa conversia FA, furnizand totodata si o motivatie mecanica pentru anticoagularea timp de cateva saptamani inainte si dupa cardioversia reusita. Desi inghetarea poate fi mai usoara la o durata de timp a FA mai scurta sau in contextul anumitor conditii asociate acesteia, cu exceptia contraindicatiilor, anticoagularea este recomandata in timpul cardioversiei si cel putin 4 saptamani dupa, tuturor pacientilor cu FA cu durata de peste 48 de ore sau necunoscuta, inclusiv in cazul FA izolate (lone atrial fibrilation).
Scaderea fluxului in AS si auriculul stang in timpul FA a fost asociata cu contrast ecografic spontan (CES), formare de tromb si evenimente embolice.86,87 In mod specific, in conditii de flux scazut, ecocardiografia transtoracica sau TEE pot decela CES sau fum, un aspect de neclaritate cu densitate variabila.88 Exista do privind faptul ca CES este un marker ar stazei produsa de FA, insa utilitatea folosirii ei pentru stratificarea prospectiva a riscului tromboembolic in plus fata de cea obtinuta prin apreciere clinica nu este inca confirmata.
Viteza fluxului in auriculul stang la pacientii cu flutter atrial este mai mica decat cea constatata de obicei in timpul ritmului sinusal, dar mai mare decat in FA. Nu este inca sigur daca aceste diferente sunt raspunzatoare pentru o eventuala scadere de prevalenta a formarii trombului in auriculul stang si a trombembolismului, asociate flutter-ului atrial. Ca si FA, flutter-ul atrial se asociaza cu viteze scazute de evacuare a auriculului stang dupa cardioversie si , deci, cu potential de trombembolie.91 De aceea anticoagularea este recomandata in mod asemanator. ( Sectiunea 8.1.4.1.3 in textul complet al ghidului, Implicatii terapeutice.)
In FA actioneaza mecanisme tromboembolice complexe care implica interactiunea factorilor de risc legati de staza atriala, disfunctia endoteliala si hipercoagulabilitatea sistemica si posibil, si locala. Asocierea puternica dintre HTA si AVC la pacientul cu FA este probabil mediata in principal de embolia cu punct de plecare auriculul stang,72 dar HTA creste si riscul AVC non-cardioembolic la pacientul cu FA.92 De aceea, se pune problema daca nu cumva, prin controlul HTA se scade riscul de AVC cardioembolic al pacientului cu FA.
Cresterea riscului de AVC al pacientului cu FA odata cu avansarea in varsta este de asemenea multifactoriala. Varsta este un factor de risc pentru ateroscleroza si placile de aterom din arcula ortic se asociaza cu AVC independent de FA.93 Varsta este un factor de risc mai puternic atunci cand se combina cu alti factori de risc, cum ar fi HTA sau sexul feminin, astfel ca femeile peste 75 de ani cu FA sunt, in mod special, la risc pentru AVC.94
Disfunctia sistolica de VS, indicata de istoricul de IC sau de aprecierea ecocardiografica, prezice AVC ischemic la pacientul cu FA care nu primeste terapie antirombotica,95 dar nu si la pacientul cu risc moderat care primeste aspirina.96,97 La pacientul cu FA, disfunctia sistolica a VS a fost asociata atat cu AVC secundar formarii de tromb in AS, cat si cu AVC non-cardioembolic.72,98
FA poate apare in legatura cu unele cauze acute temporare, cum ar fi consumul de alcool (holiday heart syndrome), interventii chirurgicale, electrocutarea, IM, pericardita, miocardita, embolia pulmonara sau alte boli pulmonare, hipertiroidia sau alte tulburari metabolice. In asemenea cazuri, tratamentul cu succes al conditiei asociate adesea elimina FA. In situatia IM, aparitia FA anunta un prognostic mai rezervat ativ cu situatia existentei FA sau a ritmului sinusal inaintea aparitiei IM.99,100 Atunci cand FA se asociaza cu flutter atrial, sindrom WPW sau tahicardie AV nodala reintranta, tratamentul aritmiei primare elimina sau reduce incidenta recurentei FA.101 FA este si o complicatie postoperatorie precoce a chirurgiei cardiace sau toracice.
Aproximatv 30% pana la 45% din cazurile de FA paroxistica si 20% pana la 25% din cazurile de FA persistenta apar la paciento tineri fara boala subiacenta demonstrabila (FA izolata).12 FA se poate prezenta ca o aritmie izolata sau familiala, desi in timp se poate releva o boala cauzatoare subiacenta.102 Cu toate ca FA poate apare la varstnici fara boala cardiaca evidenta, modificarile de structura si functie cardiaca ce insotesc imbatranirea (cum ar fi cresterea rigiditatii miocardice) se pot asocia cu FA. Pe de alta parte, boala cardiaca la varstnici poate sa nu fie legata de FA ci doar coexistenta acesteia.
Obezitatea este un important factor de risc pentru aparitia FA.103 Dupa stratificarea pentru factorii de risc clinici, excesul de risc constatat in aceasta situatie apare a fi legat de dilatarea VS. Odata cu cresterea indexului de masa corporala de la normal la supraponderal si obez, se constata o crestere graduala a marimii AS iar greutatea a fost corelata si cu regresia dilatarii AS.104 Aceste constatari sugereaza existenta unei legaturi fiziologice intre obezitate, FA si AVC, aducand in discutie posibilitatea surprinzatoare ca reducerea greutatii sa scada riscul asociat cu FA.
Printre bolile cardiovasculare asociate cu FA se numara valvulopatiile (cel mai frecvent boala valvulara mitrala), IC, boala coronariana ischemica (BCI) si HTA, in special atunci cand este prezenta hipertrofia VS (HVS). In plus, FA se poate asocia cu CMH, cardiomiopatia dilatativa, cardiopatiile congenitale, in special defectul septal atrial la adult. Etiologii posibile includ si cardiomiopatiile restrictive (de exemplu amiloidoza, hemocromatoza si fibroza endomiocardica), tumorile cardiace si pericardita constrictiva. Si alte boli cardiace cum ar fi prolapsul valvular mitral cu sau fara regurgitare mitrala, calcificarea inelului mitral, cordul pulmonar si dilatatia idiopatica a AD, au fost asociate cu o incidenta crescuta a FA. FA este frecvent intalnita la pacientii cu sindromul de apnee in somn, la care insa, nu se stie daca artimia este determinata de hipoxie, o alta anomalie biochimica, modificari ale dinamicii pulmonare sau factori tinand de AD, modificari ale tonusului vegetativ sau de catre hipertensiunea sistemica.
FA familiala, definita drept FA izolata ce apare la membrii unei familii, este mai frecventa decat se credea anterior, dar trebuie deosebita de FA secundara altor boli genetice, cum ar fi cardiomiopatiile familiale. Riscul de a dezvolta FA este mai mare la descendenti provenind din parinti cu FA, ceea ce sugereaza o susceptibilitate familiala pentru aparitia aritmiei, dar mecanismele asociate cu transmisia nu sunt obligatoriu electrice, deoarece aceeasi legatura a fost constatata si la pacienti cu istoric familial de HTA, diabet sau IC.105 Defectele moleculare responsabile pentru FA familiala sunt necunoscute. Locusuri cromozomiale specifice legate de prezenta FA in unele familii106 sugereaza posibilitatea unor mutatii genetice distincte.107
Influentele vegetative joaca un rol important in initierea FA. Masurarea variabilitatii frecventei cardiace (VFC) reflecta mai degraba modificaari ale modulatiei sistemului vegetativ si mai putin nivelurile absolute ale tonusului simpatic si parasimpatic. Totusi, se pare ca balanta dintre influentele simpatice si parasimpatice este importanta ca predictor al FA. La unii pacienti cu cord structural normal, s-a constatat in minutele imediat premergatoare instalarii FA, predominenta vagala, in timp ce la altii se remarca predominenta simpatica.108,109 Cu toate ca unii pacienti pot fi etichetati ca avand forme vagale sau adrenergice de FA, probabil ca aceste cazuri reprezinta extremele celor doua tipuri de influenta.110 In general, FA mediata vagal apare in cursul noptii sau post-prandial, in timp ce FA indusa adrenergic apare tipic in cursul zilei.111 La pacientii cu FA mediata vagal, forma de altfel cea mai fecventa, blocantele adrenergice sau digitala pot inrautatii uneori simptomele. Pentru tipul adrenergic de FA, tratamentul initial de electie este reprezentat de beta-blocante.
FA poate determina senzatia de palpitatii, poate avea consecinte hemodinamice sau tromboembolice distincte sau poae avea o perioada asimptomatica de durata necunoscuta. Monitorizarea ECG ambulatorie arata faptul ca un anume pacient poate avea perioade simptomatice dar si asimptomatice de FA.112-l14 In timp, palpitatiile pot dispare, astfel ca pacientii la care aritmia a devenit permanenta pot deveni asimptomatici. Acest lucru se intampla in mod special la varstnici. Unii pacienti sunt simptomatici doar in timpul FA paroxistice. Atunci cand sunt prezente, simptomele FA variaza in functie de neregularitatea si frecventa raspunsului ventricular, statusul functional preexistent, duata FA si alti factori tinand de pacient.115
Modalitatea initiala de pretentare a FA poate fi o complicatie embolica sau o exacerbare a IC, insa majoritatea pacientilor se g de palpitatii, durere toracica, dispnee, oboseala, senzatie de cap tulbure sau sincopa. Se poate asocia poliurie, ca urmare a eliberarii de peptid natriuretic atrial, in special la inceputul sau sfarsitul episodului de FA. Atunci cand FA se insoteste de raspuns ventricular rapid si indelungat, poate apare cardiomiopatia indusa de tahicardie, mai ales atunci cand pacientul nu realizeaza prezenta aritmiei. Sincopa este o complicatie neobisnuita ce poate apare in momentul conversiei FA, la pacienti cu disfunctie de nod sinusal sau datorita frecventei ventriculare mari, la pacienti cu CMH, stenoza valvulara aortica sau cale accesorie.
Datele existente sugereaza alterarea considerabila a calitatii vietii pacientilor cu FA ativ cu martorii de aceeasi varsta. In unele studii, mentinerea ritmului sinusal se asociaza cu o calitate a vietii si cu performanta fizica mai bune decat in cazul prezentei FA, in timp ce in alte studii nu s-a obtinut aceeasi concluzie.116 Intr-un studiu, majoritatea pacientilor cu FA paroxistica au considerat aritmia ca fiind perturbatoare a stilului de viata, perceptie care, insa, nu era asociata nici cu durata, nici cu frecventa episoadelor simptomatice.117
Diagnosticul FA necesita confirmarea prin inregistrare ECG, uneori fiind necesare inregistrarea ambulatorie Holter sau inregistrarea telemetrica. Evaluarea initiala a unui pacient cu FA suspectata sau dovedita implica determinarea tipului de aritmie (paroxistica sau persistenta), determinarea cauzei si definirea factorilor cardiaci si extracardiaci referitori la etiologie, tolerabilitate si management. Cu exceptia situatiei in care ritmul nu a fost documentat si este necesara monitorizare suplimentara, evaluarea pacientului si stabilirea terapieise pot de obicei efectua intr-o singura consultatie in ambulator (Tabelul 3).
Examenul fizic poate sugera prezenta FA pe baza pulsului periferic neregulat, a pulsului venos jugular neregulat, a variatiilor in intensitatea zgomotului 1, sau a absentei zgomotului 4 ce era decelat in timpul ritmului sinusal. Aceste constatari sunt similare si la pacientii cu flutter atrial, cu exceptia faptului ca ritmul poate fi regulat si ocazional se pot vedea oscilatii venoase rapide ale pulsului jugular.
Diagnosticul de FA necesita documentare ECG cel putin printr-o inregistrare monocanal in timpul aritmiei. La pacientii care au imtate defibrilatoare sau pacemakere, funtiile de diagnostic si memorare ale dispozitivelor permit detectarea automata si cu acuratete a artimiei.118 Radiografia toracica este utila pentru a decela eventuala patologie pulmonara asociata si pentru a aprecia circulatia pulonara. Este important ca macar o data in cursul evaluarii sa se aprecieze functiile tirodiana, renala, hepatica, ionograma serica si hemograma.119 Tuturor pacientilor cu FA trebuie sa li se efectueze ecocardiografie Doppler bi-dimensionala, in scopul aprecierii dimensiunilor AS si VS, grosimii peretelui VS, functiei VS precum si pentru a exclude boala valvulara sau pericardica oculta, ori CMH.
Prezenta trombului in AS sau in auriculul stang este rareori decelata fara TEE. Printre rezultatele TEE ce se asociaza cu trombembolia, in cazul pacientilor cu FA non-vslvulara, se numara prezenta trombului, a CES, viteza a fluxului redusa la nivelul auriculului stang si anomalii ateromatozice aortice,120 insa este nevoie de studii prospective pentru a a aceste date cu predictorii de trombembolie clinici si cei rezultati din ecocardiografia transtoracica. 81
Tabelul 3. Evaluarea clinica a pacientului cu FA
|
Evaluare minima |
|
1. Anamneza si examen fizic pentru a defini |
|
Prezenta si natura simptomelor asociate FA Tipul clinic de FA (prim episod, paroxistica, persistenta sau permanenta) Debutul primului episod simptomatic sau data descoperirii FA Frecventa, durata, factorii precipitanti si modul de terminare a FA Raspunsul la vreun agent farmacologic administrat Prezenta unei boli cardiace asociate sau a unei alte conditii reversibile (ex. hipertiroidia sau consumul de alcool) |
|
2. Electrocardiograma, pentru a identifica |
|
Ritmul (a verifica FA) Hipertrofia VS Durata si morfologia undei P sau a undelor de fibrilatie Preexcitatia Blocul de ramura IM precedent Alte aritmii atriale Pentru a masura intervalele R-R, QRS si QT si a le urmari in legatura cu medicamentele antiaritmice |
|
3. Ecocardiografie transtoracica, pentru a identifica |
|
Valvulopatie Dimensiunile AS si AD Functia si dimensiunile VS Presiunea de varf a VD (hipertensiune pulmonara) Hipertrofia VS Boala pericardica |
|
4. Teste sanghine privind functiile tiroidiana, renala, hepatica |
|
La primul episod de FA, atunci cand frecventa ventriculara este greu de controlat |
|
Teste aditionale (Pot fi necesare unul sau mai multe teste) |
|
1. Testul de mers 6 minute |
|
Daca se pune problema controlului inadecvat al frecventei ventriculare |
|
2. Testare de efort |
|
Daca se pune problema controlului inadecvat al frecventei ventriculare (FA permanenta) Pentru a reproduce FA indusa de efort Pentru a exclude ischemia inaintea inceperii tratamentului cu antiaritmice de clasa IC la pacienti selectionati |
|
3. Monitorizare Holter |
|
Daca se pune in discutie diagnosticul sau tipul de aritmie Ca o metoda de evaluare a controlului frecventei cardiace |
|
4. Ecocardiografia transesofagiana |
|
Pentru identificarea trombului din AS (in auriculul stang) Pentru a ghida cardioversia |
|
5. Studiu electrofiziologic |
|
Pentru a clarifica mecanismul tahicardiei cu complexe QRS largi Pentru a identifica o aritmie predispozanta cum ar fi flutter atrial sau tahicardia paroxistica supraventriculara Pentru a cauta locuri de efectuare a ablatiei curative sau a modificarii/blocarii conducerii AV |
|
6. Radiografie toracica, pentru a evalua |
|
Parenchimul pulmonar, atunci cand examenul fizic sugereaza o anomalie Circulatia pulmonara, atunci cand examenul fizic sugereaza o anomalie |
Tipul IC se refera la clasificarea Vaughn-Williams a medicamentelor antiaritmice ( Tabelul 14)
FA indica fibrilatie atriala; AV, atrioventricular; AS, atriul stang; VS, ventriculul stang; IM, infarct miocardic; AD, atriul drept; VD, ventriculul drept
Managementul pacientilor cu fibrilatie atriala are 3 obiective controlul frecventei ventriculare, preventia trombembolismului, si corectarea tulburarii de ritm care nu se exclud reciproc. Managementul initial implica o strategie pentru controlul frecventei ventriculare sau pentru controlul ritmului. Strategia de controlul frecventei presupune controlul frecventei ventriculare fara obligatia restabilirii sau mentinerii ritmului sinusal. Strategia de control a ritmului incearca restabilirea si/sau mentinerea ritmului sinusal. Ultima strategie necesita de asemenea atentie asupra controlului frecventei. In functie de evolutia pacientului, strategia initial aleasa se poate dovedi fara succes si ulterior fiind adoptata strategia alternativa. Indiferent daca este urmata strategia pentru controlul frecventei sau al ritmului, atentia trebuie sa fie indreptata, de asemenea asupra terapiei antitrombotice, pentru preventia trombembolismului.
Medicamentele si ablatia sunt eficiente pentru controlul frecventei si al ritmului, iar in circumstante speciale chirurgia poate fi optiunea preferata. Indiferent de abordare, necesitatea anticoagularii se bazeaza pe riscul dezvoltarii accidentelor vasculare cerebrale (AVC) si nu pe posibilitatea mentinerii ritmului sinusal. In mod caracteristic, pentru controlul ritmului, medicamentele sunt prima alegere, iar ablatia AS este a doua alegere, mai ales pentru pacientii cu FA izolata simptomatica. Pentru cativa pacienti, in special tineri, cu FA foarte simptomatica, care necesita restabilirea ritmului sinusal, dupa ani de terapie medicamentoasa, ablatia cu radiofrecventa poate fi preferata. Pacientii cu FA preoperatorie cu inteventie chirurgicala cardiaca sunt in fata unei oportunitati unice. Pentru preventia recurentei FA postoperator, unii sunt candidati pentru tratamentul chirurgical curativ al FA, folosind tehnica maze sau ablatia AS, aceste abordari putand fi si proceduri eficiente ajutatoare bypass-ului coronarian sau interventiilor chirurgicale de reparare valvulara. Deoarece urechiusa AS este locul unde sunt detectati mai mult de 95% din trombi, aceasta structura este de obicei indepartata din circulatie in timpul interventiei chirurgicale la pacientii cu risc de a dezvolta FA postoperator, desi aceasta nu s-a dovedit utila in preventia AVC-ului (121).
Pentru pacientii cu FA simptomatica ce dureaza de mai multe saptamani, tratamentul initial este anticoagularea si controlul frecventei ventriculare, insa pe termen lung, scopul este restabilirea ritmului sinusal. Cand durata FA este necunoscuta sau depaseste 48 de ore si cardioversia este luata in considerare, pacientii care nu necesita anticoagulare pe termen lung pot beneficia de tratament anticoagulant pe termen scurt. Restabilirea ritmului sinusal devine un scop clar pe termen lung, daca controlul frecventei ventriculare nu ofera o ameliorare adecvata a simptomatologiei. Cardioversia precoce poate fi necesara daca FA determina hipotensiune sau agravarea insuficientei cardiace (IC). Dimpotriva, ameliorarea simptomelor prin controlul frecventei ventriculare la pacientii varstnici, indeparteaza clinicianul de incercarea restabilirii ritmului sinusal. In unele situatii cand cauza fiziopatologica ce initiaza FA este reversibila, cum este de exemplu tireotoxicoza sau interventia chirurgicala cardiaca, nu mai este necesar tratamentul pe terment lung.
Trialurile randomizate ce a strategia de control al ritmului versus strategia de control al frecventei ventriculare, la pacientii cu FA sunt rezumate in Tabelele 4, 5 si 6. Printre acestea, AFFIRM (Atrial Fibrillation Follow-up Investigation of Rhythm Management) nu a gasit nici o diferenta in ceea ce priveste mortalitatea sau frecventa AVC-ului intre pacientii care au urmat una sau cealalta strategie. Trialul RACE (Rate Control vs. Electrical cardioversion for persistent atrial fibrillation) a gasit controlul frecventei nefiind inferior controlului ritmului pentru preventia mortalitatii sau morbiditatii. Recurentele FA clinic silentioase la pacientii asimptomatici tratati cu antiaritmice pot fi responsabile de evenimentele tromboembolice aparute dupa renuntarea la anticoagulare. Deci, pacientii cu risc inalt pentru AVC necesita anticoagulare indiferent daca este aleasa strategia de control al frecventei sau control al ritmului, dar trialul AFFIRM nu a fost proiectat pentru a se referi la aceasta problema (122). Desi analiza secundara sustine aceasta idee, frecventa AVC-ului la pacientii atribuiti strategiei de control al ritmului si care au oprit warfarina este ambigua, si cercetari suplimentare sunt necesare pentru a raspunde la aceasta intrebare.
Informatii despre efectele medicamentelor antiaritmice si cronotrope asupra calitatii vietii sunt inconsecvente (116, 130, 131). Nici unul din studiile AFFIRM (132), RACE (124), PIAF (Pharmacological Intervention in Atrial Fibrillation) (125) sau STAF (Strategies of Treatment of Atrial Fibrillation) (126) nu au gasit diferente in ceea ce priveste calitatea vietii cu controlul ritmului sau a frecventei. Controlul ritmului in studiile PIAF sau HOT CAFE (How to Treat Chronic Atrial Fibrillation) (127) a determinat o toleranta mai buna la efort decat controlul frecventei, dar aceasta nu s-a tradus intr-o imbunatatire a calitatii vietii. Imbunatatirea simptomelor a fost raportata dupa procedura maze la pacientii cu FA (133). Cu toate acestea, clinicienii trebuie sa judece interpretarea modificarii calitatii vietii la aceasta populatie selectata in sensul in sensul starii de bine a fiecarui pacient in parte. Pacientii cu aceeasi stare de sanatate pot avea total diferita calitatea vietii, si tratamentul trebuie ajustat in functie de natura, intensitatea si frecventa simptomelor, preferinta pacientului, comorbiditati si raspunsul la tratament, pentru fiecare individ in parte.
In functie de simptome, controlul frecventei poate fi tratamentul initial acceptabil la pacintii varstnici cu FA persistenta, care au hipertensiune sau insuficienta cardiaca. Pentru indivizii mai tineri, mai ales cei cu FA izolata paroxistica, controlul ritmului poate fi o abordare initiala mai buna. Adesea este necesara medicatia care are atat efecte antiaritmice cat si de control al frecventei. Ablatia cu cateter ar trebui sa fie luata in considerare la pacienti selectati care nu raspund la medicatia antiaritmica (134).
La pacientii cu FA, frecventa ventriculara poate fi crescuta excesiv la efort chiar si atunci cand este bine controlata in repaus. In afara de faptul ca permite un timp adecvat pentru umplerea ventriculara si ca evita ischemia dependenta de frecventa, cresterea conducerii intraventriculare prin reducerea frecventei, poate determina imbunatatirea hemodinamicii. Poate fi util sa evaluezi raspunsul frecventei cardiace la efort maximal sau submaximal sau sa monitorizezi frecventa pe o perioada indelungata (ex. prin utilizarea inregistrarii Holter pe 24 de ore).
Definitia controlului adecvat al frecventei ventriculare s-a bazat initial pe beneficiile hemodinamice pe termen scurt si nu s-a sudiat bine cu privire la regularitatea sau iregularitatea raspunsului ventricular in FA, la calitatea vietii, simptomelor sau dezvoltarii cardiomiopatiei. Nici o metoda standard pentru evaluarea controlului frecventei cardiace nu a fost stabilita sa ghideze managementul pacientrilor cu fibrilatie atraiala. Criteriile pentru controlul frecventei variaza cu varsta pacientuli, dar de obicei implica obtinerea unei frecvente ventriculare intre 60 si 80 batai/minut in repaus si intre 90 si 115 batai/minut la efort moderat.
Pacientii care sunt simptomatici avand FA cu frecventa ventriculara rapida necesita management medical prompt si cardioversia ar trebui sa fie luata in considerare, daca apare hipotensiune simptomatica sau insuficienta cardiaca. O tahicardie sustinuta, necontrolata poate conduce la deteriorarea functiei ventriculare (cardiomiopatie indusa de tahicardie) care se amelioreaza prin controlul frecventei. Cardiomiopatia indusa de tahicardie tinde sa se remita in 6 luni de control al frecventei sau al ritmului; cand tahicardia se repeta fractia de ejectie a ventriculului stang scade si dupa o perioada mai scurta se dezvolta insuficienta cardiaca, si aceasta este asociata cu un prognostic relativ prost (137).
In FA, perioada refractara functionala a nodului AV se coreleaza invers cu frecventa ventriculara, si medicamentele care prelungesc perioada refractara sunt in general eficiente pentru controlul frecventei. Nu sunt evidente ca, controlul farmacologic al freventei are vreo influenta negativa asupra functiei VS, dar bradicardia si blocul cardiac pot apare ca efecte nedorite ale beta blocantelor, amiodaronei, digitalei sau antagonistilor canalelor de calciu nondihidropiridine, mai ales la pacientii cu FA paroxistica, in special la varstnici. Medicatia poate fi administrata intravenos cand controlul rapid al raspunsului ventricular in FA este necesar sau administrarea orala a medicamentelor nu este posibila. Medicatia cronotrop negativa poate fi administrata pe cale orala, la pacientii stabili hemodinamic cu raspuns ventricular rapid al FA (Tabel 7). Combinatiile pot fi necesare pentru a obtine un control al frecventei in ambele situatii acute si cronice. Unii pacienti dezvolta bradicardie simptomatica care necesita pacing permanent. Tratamentul nonfarmacologic ar trebui sa fie luat in considerare cand masurile farmacologice sunt insuficiente.
Tabelul 4. Studii care a strategii pentru controlul frecventei si controlul ritmului la pacienti cu fibrilatie atriala
|
Studiul |
Referinta |
Pacienti |
Durata FA |
Urmarire (ani) |
Varsta (media - ani +/- SD) |
Pacienti in RSa |
Evenimente clinice |
|||
|
|
|
|
|
|
|
|
Accident vascular/Embolie |
Deces |
||
|
|
|
|
|
|
|
|
Frecventa |
Ritm |
Frecventa |
Ritm |
|
AFFIRM (2002) |
128 |
4060 |
b/NR |
3,5 |
70+/-9 |
35% vs 63% (la 5 ani) |
88/2027 |
93/2033 |
10/2027 |
356/2033 |
|
RACE (2002) |
124 |
522 |
11-399 zile |
2,3 |
68+/-9 |
10% vs 39% (la 2,3 ani) |
7/256 |
16/266 |
18/256 |
18/266 |
|
PIAF (2000) |
130 |
252 |
7-360 zile |
1 |
61+/-l0 |
10% vs 56% (la 1 an) |
0/125 |
2/127 |
2/125 |
2/127 |
|
STAF |
126 |
200 |
6 +/- 3 luni |
1,6 |
66+/-8 |
11% vs 26% (la 2 ani) |
2/100 |
5/100 |
8/100 |
4/100 |
|
HOT CAFE (2004) |
127 |
205 |
7-730 zile |
1,7 |
61+/-l1 |
NR vs 64% |
1/101 |
3/104 |
1/101 |
3/104 |
aComparatie intre grupurile de pacienti la care s-a realizat controlul ritmului sau controlul frecventei.
bAproximativ 1/3 din pacienti au fost inrolati cu primul episod de fibrilatie atriala (FA).
AFFIRM indica Atrial fibrilation Follow-Up Investigation of Rhythm Management; HOT CAF, How to Treat Chronic Atrial Fibrilation; PIAF, Pharmacological intervention in Atrial Fibrilation; RACE, Rate control Versus Electrical Cardioversion for Persistent Atrial Fibrilation; STAF, Strategies of Treatment of Atrial Fibrilation.
Tabelul 5. Caracteristici generale ale studiilor pentru controlul ritmului si frecventei la pacientii cu fibrilatie atriala
|
Studiu |
Referinta |
Pacienti (n) |
Varsta medie (ani) |
Urmarire medie (ani) |
Criterii de includere |
Endpoint primar |
Pacienti care ating endpoint-ul primar (n) |
p |
|
|
|
|
|
|
|
|
|
Control frecventa |
Control ritm |
|
|
PIAF (2000) |
|
|
|
|
FA persistenta (7-360 zile) |
Ameliorare simptomatica |
|
|
|
|
RACE (2002) |
|
|
|
|
Flutter sau FA persistente de < 1 an, cu 1-2 cardioversii in 2 ani si anticoagulante orale |
Compus: deces cardiovascular, IC, hemoragie severa, imtare PM, evenimente tromboembolice, reactii adverse severe ale antiaritmicelor |
|
|
|
|
STAF (2002) |
|
|
|
|
FA persistenta (> 4 saptaman, < 2 ani), atriul stang >45 mm, IC clasa NYHA II-IV, FE<45% |
Compus: mortalitate totala, complicatii cerebrovasculare, resuscitare, evenimente embolice |
|
|
|
|
AFFIRM (2002) |
|
|
|
|
FA paroxistica sau persistenta,varsta ≥ 65 ani sau risc de AVC sau deces |
Mortalitate de orice cauza |
|
|
|
|
HOT CAFE (2004) |
|
|
|
|
Primul episod clinic de FA persistenta (≥ 7 zile si < 2 ani), varsta 50-70 ani |
Compus: deces, complicatii tromboembolice, hemoragii majore intracraniene sau altele |
|
|
|
Retiparit cu permisiunea Pelargonio G., Prystowsky EN, Controlul ritmului versus frecventei in managementul pacientilor cu fibrilatie atriala. Nat Clin Pract Cardiovasc Med 2005;2:514-21 (129).
FAindica fibrilatie atriala, AFFIRM , A trial fibrilation Follow-Up Investigation of Rhythm Management; HOT CAF, How to Treat Chronic A trial Fibrilation; PIAF, Pharmacological intervention in A trial Fibrilation; RACE, Rate control Versus Electrical Cardioversion for Persistent A trial Fibrilation; STAF, Strategies of Treatment of A trial Fibrilation; CV , cardiovascular; ICC, insuficienta cardiaca congestiva; NYHA, New York Heart Association; PM, pacemaker; ETE evenimente tromboembolice; ARR antiaritmice; As atriu stang; FEVS, fractia de ejectie a ventriculului stang; RCP, resuscitare cardiopulmonara; AVC, accident vascular cerebral.
Tabelul 6. Compararea rezultatelor adverse in trialurile pentru controlul ritmului si frecventei la pacientii cu fibrilatie atriala.
|
Studiul |
Referinta |
Decese de orice cauza (n frecventa /ritm) |
Decese de cauze cardio-vasculare |
Decese de cauze non-cardio-vasculare |
AVC |
Evenimente trombo-embolice |
Hemoragii |
|
RACE (2002) |
|
|
|
ND |
ND |
|
|
|
PIAF (2002) |
|
|
|
1a |
ND |
ND |
ND |
|
STAF (2003) |
|
|
|
|
|
ND |
|
|
AFFIRM (2002) |
|
|
|
|
|
ND |
|
|
HOT CAFE (2004) |
|
|
|
|
|
ND |
|
aNumarul total de pacienti neraportati.
Retiparit cu permisiunea Pelargonio G., Prystowsky EN, Controlul ritmului versus frecventei in managementul pacientilor cu fibrilatie atriala. Nat Clin Pract Cardiovasc Med 2005;2:514-21 (129).
FA indica fibrilatie atriala, AFFIRM , Atrial fibrilation Follow-Up Investigation of Rhythm Management; HOT CAF, How to Treat Chronic Atrial Fibrilation; PIAF, Pharmacological intervention in Atrial Fibrilation; RACE, Rate control Versus Electrical Cardioversion for Persistent Atrial Fibrilation; STAF, Strategies of Treatment of Atrial Fibrilation; AVC, accident vascular cerebral; ND, nedeterminate.
La pacientii cu sindrom WPW si tahicardie asociata cu preexcitatie ventriculara este contraindicata administrarea intravenoasa a beta blocantelor, digitalei, adenozinei, lidocainei si antagonistilor canalelor de calciu nondihidropiridine, toate medicamentele care incetinesc conducerea la nivelul nodului AV, deoarece ele pot facilita conducerea antegrada dealungul caii accesorii in timpul FA (2), determinand accelerarea frecventei ventriculare, hipotensiune sau fibrilatie ventriculara. (62). Cardioversia electrica directa imediata este indicata cand aritmia este asociata cu compromitere hemodinamica. La pacientii stabili hemodinamic cu preexcitaie pot fi administrate intravenos antiaritmicele tip I sau amiodarona. Beta blocantele si blocantele canalelor de calciu sunt rezonabile ca tratament de intretinere pe cale orala.
Un pacient cu medicamente ce blocheaza nodul AV al carui raspuns ventricular este bine controlat in timpul FA, poate avea o crestere sau reducere a frecventei daca dezvolta flutter atrial. Aceasta apare de asemenea, cand antiaritmice ca propafenona sau flecainida sunt folosite pentru prevenirea FA recurente. Acesti compusi pot creste probabilitatea conducerii AV 1:1 in timpul flutterului atrial conducand la un raspuns ventricula foarte rapid. Astfel, cand acesti agenti sunt administrati pentru profilaxia recurentelor FA paroxistice sau a flutterului atrial, ar trebui coadministrate medicamente care blocheaza nodul AV. O exceptie pot fi pacientii cu FA paroxistica si cu ablatie cu cateter la nivelul istmului cavo-tricuspidian pentru prevenirea flutterului atrial.
Deoarece pacing-ul ventricular prelungeste perioada refractara a nodului AV ca rezultat al conducerii retrograde ascunse, poate elimina ciclurile ventriculare mai lungi si poate reduce numarul ciclurilor ventriculare scurte induse de conducerea AV rapida in timpul FA. Pacing-ul la frecventa aproximativ egala cu cea ventriculara medie din timpul conducerii AV spontane, poate controla ritmul ventricular in timpul FA (139). Acesta poate fi util pacientilor cu variabilitate marcata a frecventei ventriculare sau celor care dezvolta bradicardie de repaus in timpul tratamentului medicamentos. La unii pacienti, activarea ventriculara asincrona din timpul pacing-ului ventricular drept poate neutraliza beneficiul revascularizarii .
Ablatia nodului AV asociat cu imtarea pacemaker-ului permanent ofera un control cat se poate de eficient al frecventei ventriculare si amelioreaza simptomele la pacientii selectati cu FA. (140-l43). In general, pacientii care beneficiaza cel mai probabil de aceasta strategie sunt cei care au simptome sau cardiomiopatie mediata de tahicardie asociate cu o frecventa ventriculara rapida in timpul FA, care nu pot fi controlati adecvat cu medicatie antiaritmica sau cronotrop negativa. Meta-analiza a 21 de studii publicate intre 1989-l998, care include un total de 1181 pacienti, a conchis ca ablatia nodului AV si imtarea pacemaker-ului permanent la pacientii cu FA simptomatica refractara la tratamentul medicamentos, imbunatatesc semnificativ simptomele, calitatea vietii si utilizarea serviciilor de sanatate (143). Ablatia cu cateter a impulsurilor atriale inferioare de la nodul AV incetineste frecventa ventriculara in timpul FA si imbunatateste simptomele fara imtarea pacemaker-ului (144, 145). Totusi, aceasta tehnica are cateva limite, incluzand bloc AV complet inadvertent si o tendinta a cresterii frecventei ventriculare dupa 6 luni de la ablatie. Astfel modificarea nodului AV fara imtarea pacemaker-ului este numai rareori folosita.
Desi beneficiile simptomatice determinate de ablatia nodului AV sunt clare, limitele includ necesitatea anticoagularii permanente, pierderea sincronismului AV si dependenta pentru toata viata, de pacemaker. De asemenea, exista un risc limitat de moarte subita datorita torsadelor de varfuri sau fibrilatiei ventriculare (146). Pacientii cu anomalii ale compliantei ventriculare diastolice care depind de sincronismul AV pentru mentinerea debitului cardiac, cum sunt cei cu cardiomiopatie hipertrofica sau boala cardiaca hipertensiva, pot avea simptome persistente dupa ablatia nodului AV si imtarea pacemaker-ului. Deci, pacientii ar trebui sfatuiti cu privire la fiecare dintre aceste considerente inaintea efectuarii acestor masuri ireversibile.
Printre pacientii la care se realizeaza ablatia nodului AV, cei cu functie VS normala sau disfunctie VS reversibila beneficiaza cel mai probabil de procedura standard de ablatie a nodului AV si imtarea pacemaker-ului. Pentru cei cu functie VS alterata nu din cauza tahicardiei, pacemaker-ul biventricular cu sau fara capacitate de defibrilator, ar trebui sa fie luat in considerare. Upgradarea la dispozitiv biventricular ar trebui luata in considerare pentru pacientii cu insuficienta cardiaca si sistem de pacing ventricular drept care au efectuat ablatia nodului AV (147).
Intru-un studiu mic, retrospectiv, populational, din Districtul Olmsted, Minesota, pe o perioada de 30 de ani, frecventa cumulata a AVC-ului pe 15 ani la populatia cu FA izolata (definita ca FA a pacientilor mai tineri de 60 de ani, fara istoric clinic sau semne ecocardiografice de boala cardiopulmonara) a fost 1,3% (5). In studiul SPAF (Stroke prevention in Atrial Fibrillation III) incidenta AVC-ului ischemic in timpul tratamentului cu aspirina a fost similara pentru cei cu FA paroxistica (3,2%) si permanenta (3,3%) (148). Cei cu AVC sau accident ischemic tranzitor (AIT) in antecedente au o incidenta de 10-l2% pe an pentru un nou AVC, daca au fost tratati cu aspirina, acestia beneficiind considerabil de anticoagularea orala in doza ajustata (149). In afara de antecedentele de trombembolism, insuficienta cardiaca, hipertensiunea, inaintarea in varsta, si diabetul zaharat au aparut consecvent ca factori de risc independenti pentru AVC-ul ischemic asociat cu FA nonvalvulara (96). Alti factori cum ar fi sexul feminin, tensiunea arteriala sistolica peste 160mmHg, si disfunctia VS au fost asociati in mod variabil cu AVC-ul (96). Riscul relativ al AVC-ului ischemic asociat cu caracteristici clinice specifice, provenit din analizarea sumata a participantilor care nu au primit terapie antitrombotica in grupurile control a 5 trialuri randomizate, este prezentat in Tabelul 8. La pacientii cu FA nonvalvulara, AVC-ul sau AIT-ul in antecedente sunt predictorii independenti cei mai puternici ai unui nou AVC, fiind semnificativ asociate cu AVC-ul in toate cele 6 studii in care au fost evaluate, determinand o crestere a riscului relativ intre 1,9 si 3,7 (media aproximat 3). Toti pacientii cu AVC sau AIT in antecedente necesita anticoagulare, daca aceasta nu este contraindicata. Varsta este un predictor independent solid al AVC-ului (. 3), dar populatia mai in varsta este de asemenea, la risc crescut pentru sangerarile induse de anticoagulare (150). Considerarea speciala a acestor pacienti mai varstnici este de aceea un aspect critic al profilaxiei eficiente a AVC-ului (151).
Ecocardiografia este valoroasa in definirea etiologiei FA (ex. detectand boala mitrala reumatismala sau cardiomiopatia hipertrofica obstructiva) si adauga informatii utile in stratificarea riscului trombembolic. Printre pacientii cu FA cu risc inalt, functia sistolica alterata evidentiata la ecografia transtoracica, trombul, contrastul spontan sau reducerea velocitatii fluxului sangvin in urechiusa AS si placa ateromatoasa complexa la nivelul aortei toracice evidentiate la ecografia transesofagiana au fost asociate cu trombembolismul, si anticoagularea orala eficienta reduce riscul AVC-ului la pacientii cu FA si aceste caracteristici. Diametrul AS si anomaliile endocardice fibrocalcare au fost inconstant asociate cu trombembolismul. Daca absenta acestor anomalii ecocardiografice identifica un grup de pacienti cu risc scazut care ar putea evita in siguranta, anticoagularea nu a fost stabilit, limitand valoarea ecocardiografiei ca determinant fundamental al necesitatii anticoagularii cronice la pacientii cu FA.
Tabelul 7. Agenti farmacologici administrati intravenos si oral pentru controlul frecventei cardiace la pacientii cu fibrilatie atriala.
|
Medicament |
Clasa / ND pentru recomandare |
Doza de incarcare |
Debut |
Doza de intretinere |
Reactii adverse majore |
|
Situatii acute |
|||||
|
Controlul frecventei cardiace la pacientii fara cai accesorii |
|||||
|
Esmololab |
Clasa I / ND C |
500mcg/kc i.v. in 1min |
5 min. |
60 - 200 mcg/kg/min. iv. |
¯TA, c, astm, IC |
|
Metoprololb |
Clasa I / ND C |
2,5-5 mg bolus iv. in 2 min.; pana la 3 doze |
5 min. |
NA |
¯TA, BAV, ¯AV, astm, IC |
|
Propranololb |
Clasa I / ND C |
0,15 mg/kg iv. |
5 min. |
NA |
¯TA, BAV, ¯AV, astm, IC |
|
Diltiazem |
Clasa I / ND B |
0,25 mg/kg iv. in 2 min. |
2 - 7 min. |
5 - 15 mg/h iv. |
¯TA, BAV, IC |
|
Verapamil |
Clasa I / ND B |
0,075-0,15 mg/kg iv. in 2 min. |
3 - 5 min. |
NA |
¯TA, BAV, IC |
|
Controlul frecventei cardiace la pacientii cu cai accesoriid |
|||||
|
Amiodaronace |
Clasa a IIa, ND C |
150 mg in 10 min |
zile |
0,5 - 1 mg/min iv. |
¯TA, BAV, toxicitate pulmonara, coloratie cutanata, hipotiroidism, hipertiroidism, depozite corneene, neuropatie optica, interactiune cu warfarina, bradicardie sinusala |
|
Controlul frecventei cardiace la pacientii cu insuficienta cardiaca, fara cai accesorii |
|||||
|
Digoxin |
Clasa I, ND B |
0,25 mg iv. la 2 ore, pana la 1,5 mg |
≥ 60 min.d |
0,125 - 0,375 mg/zi iv. sau oral |
Toxicitate digitalica, BAV, ¯AV |
|
Amiodaronac |
Clasa a IIa, ND C |
150 mg in 10 min |
zile |
0,5 - 1 mg/min iv. |
¯TA, BAV, toxicitate pulmonara, coloratie cutanata, hipotiroidism, hipertiroidism, depozite corneene, neuropatie optica, interactiune cu warfarina, bradicardie sinusala |
|
Situatii non-acute sau terapie cronica de intretineref |
|||||
|
Controlul frecventei cardiace |
|||||
|
Metoprololb |
Clasa I / ND C |
Aceeasi ca doza de intretinere |
4 - 6 ore |
25 - 100 mg x 2/zi, oral |
¯TA, BAV, ¯AV, astm, IC |
|
Propranololb |
Clasa I / ND C |
Aceeasi ca doza de intretinere |
60 - 90 min. |
80 - 240 mg/zi in 4 doze, oral |
¯TA, BAV, ¯AV, astm, IC |
|
Diltiazem |
Clasa I / ND B |
Aceeasi ca doza de intretinere |
2 - 4 ore |
120 - 360 mg/zi divizat; preparate cu eliberare prelungita; oral |
¯TA, BAV, IC |
|
Verapamil |
Clasa I / ND B |
Aceeasi ca doza de intretinere |
1 - 2 ore |
120 - 360 mg/zi divizat; preparate cu eliberare prelungita; oral |
¯TA, BAV, IC |
|
Controlul frecventei cardiace la pacientii cu insuficienta cardiaca, fara cai accesorii |
|||||
|
Digoxin |
Clasa I, ND C |
0,5 mg oral zilnic |
2 zile |
0,125 - 0.375 mg/zi, oral |
Toxicitate digitalica, BAV, ¯AV |
|
Amiodaronac |
Clasa IIb, ND C |
800 mg/zi 1 saptamana, oral; 600 mg/zi 1 saptamana, oral; 400 mg/zi 4 - 6 saptamani, oral |
1 - 3 saptamani |
200 mg/zi, oral |
¯TA, BAV, toxicitate pulmonara, coloratie cutanata, hipotiroidism, hipertiroidism, depozite corneene, neuropatie optica, interactiune cu warfarina, bradicardie sinusala |
a Debutul este variabil si cateva efecte apar mai devreme.
b In tabel sunt inclusi numai membrii reprezentativi ai agentilor blocanti beta adrenergici, dar si alti agenti similari ar putea fi folositi pentru aceasta indicatie in doze optime. Betablocantii sunt grupati in ordine alfabetica.
c Amiodarona poate fi folosita pentru controlul frecventei cardiace la pacientii cu FA cand alte masuri sunt fara succes sau sunt contraindicate.
d Conversia la ritm sinusal si ablatia cu cateter sunt in general recomandate; terpia farmacologica pentru controlul rimului poate fi potrivita pentru anumiti pacienti.
e Amiodarona i.v. este recomandata, daca ritmul nu poate fi convertit sau ablatat si controlul frecventei este necesar.
Controlul adecvat al freventei cardiace ar trebui evaluat atat in timpul activitatii fizice, cat si la efort.
¯TA indica hipotensiune; ¯AV, bradicardie; BAV bloc atrioventricular, IC insuficienta cardiaca; ND, nivel de do; NA neaplicabil.
Tabelul 8. Factori de risc pentru accident vascular ischemic si
embolie sistemica la pacientii cu fibrilatie atriala
|
Factori de risc |
Risc relativ |
|
AVC sau AIT in antecedente |
|
|
Diabet zaharat |
|
|
Istoric de hpertensiune |
|
|
Insuficienta cardiaca |
|
|
Varsta inaintata (continuu, pe decade) |
|
Date obtinute din analizarea sumata a 5 grupuri control netratate din trialuri pentru preventia primara (17). Ca un grup pacientii cu fibrilatie atriala nonvalvulara au risc de trombembolism de 6 ori mai mare decat pacientii in ritm sinusal. Riscul relativ se refera la atia pacientilor cu fibrilatie atriala cu pacientii fara acesti factori de risc.
AVC indica accident vascular cerebral; AIT, accident ischemic tranzitor.
ura 3 Procentele AVC-urilor in functie de varsta printre pacientii din grupurile control netratate din trailurile randomizate ale terapiei antitrombotice. Datele provin de la Investigatorii Fibrilatiei Atriale. Factorii de risc pentru AVC si eficienta terapiei antitrombotice in fibrilatia atriala. Analiza datelor adunate din 5 trialuri randomizate. Arch Intern. Med 1994; 154:1449-l45 (17).
Procentul AVC-urilor (% pe an)
<65 65-75 >75
Varsta (ani)
Cateva scheme clinice au fost propuse pentru stratificarea riscului AVC-ului ischemic la pacientii cu FA, bazate pe analiza cohortelor de participanti monitorizati prospectiv in trialuri clinice in care terapia antitrombotica a fost controlata. Alte criterii au fost dezvoltate prin consensul expertilor, sa clasifice pacientii in grupuri de risc scazut, intermediar si inalt. Altii au folosit separarea recursiva si alte tehnici pentru identificarea pacientilor cu risc scazut. CHADS2 (Cardiac Failure insuficienta cardiaca, Hypertension hipertensiune, Age varsta, Diabetes diabet, Stroke (doubled)- AVC (dublat)) intergreaza elemente de la cateva astfel de scheme si se bazeaza pe un sistem de puncte in care doua puncte sunt atribuite istoricului de AVC sau AIT si cate 1 punct este atribuit varstei peste 75 de ani, istoricului de hipertensiune, diabetului sau insuficientei cardiace recente (tabel 9) (152, 153). Valoarea predictiva a acestui sistem de scoruri a fost evaluata la 1733 beneficiari Medicare cu FA nonvalvulara, cu varsta intre 65-95 ani, care nu au primit anticoagulare la externare. Desi scorurile mari au fost asociate cu o frecventa crescuta a AVC-ului la aceasta cohorta de varstnici, cativa pacienti au avut un scor de 5 sau mai mare si un scor de 0.
Desi aceste scheme pentru stratificarea riscului pentru AVC identifica pacientii care beneficiaza cel mai mult si cel mai putin de anticoagulare, pragul pentru utilizarea anticoagularii este controversat. Opinia este in special impartita in ceea ce priveste anticoagularea celor cu risc intermediar (incidenta AVC-ului intre 3-5%). Unii sustin utilizarea de rutina a anticoagularii la cei cu frecventa AVC-ului intre aceste limite (154), in timp ce altii prefera anticoagularea selectiva a pacientilor cu risc intermediar, dand importanta riscului individual de sangerare si preferintelor pacientilor (24). Pragul beneficiului de la care pacientii cu FA aleg anticoagularea variaza, unii cu risc intermediar aleg anticoagularea, in timp ce altii nu o aleg (155). Recomandarile noastre pentru terapia antitrombotica sunt rezumate in tabelul 10.
Tabelul 9. Riscul de accident vascular cerebral la pacientii cu fibrilatie atriala netrata cu anticoagulant conform indexului CHADS2
|
Criteriile de risc CHADS2 |
Scor |
|
|
AVC sau AIT in antecedente |
|
|
|
Varsta >75ani |
|
|
|
Hipertensiune |
|
|
|
Diabet zaharat |
|
|
|
Insuficienta cardiaca |
|
|
|
Pacienti (N=1733) |
Procentul ajustat al AVC (%/an)a (95% IC) |
Scorul CHADS2 |
|
|
1,9 (1,2 la 3) |
|
|
|
2,8 (2 la 3,8) |
|
|
|
4 (3,1 la 5,1) |
|
|
|
5,9 (4,6 la 7,3) |
|
|
|
8,5 (6,3 la 11,1) |
|
|
|
12,5 (8,2 la 17,5) |
|
|
|
18,2 (10,5 la 27,4) |
|
a Procentul AVC-ului ajustat este obtinut din analiza mutivariata oresupunand absenta utilizarii aspirinei. Datele provin din van Walraven WC, Hart RG, Wels GA, et al. O regula de predictie clinica pentru identificarea pacientilor cu fibrilatie atriala si risc mic pentru AVC in timp ce primesc aspirina arch Intern Med 2003; 163: 936-43 (153); si Gage BF, Waterman AD, Shannon W, et al. Validarea schemelor de clasificare clinica pentru prezicerea accidentului vascula cerebral: rezultate din Registrul National al fibrilateie atriale JAMA 2001; 285:2864-70 (152).
CHADS2 indica insufic9enta cardiaca, hipertensiune, varsta, diabet, accident vascular cerebral (dublat); IC, interval de confidenta; AIT, accident ischemic tranzitor.
Tabelul 10. Terapia antitrombotica la pacientii cu fibrilatie atriala
|
Categorie de risc |
Terapia recomandata |
|
|
Nici un factor de risc |
Aspirina 81 - 325 mg/zi |
|
|
Un factor de risc moderat |
Aspirina 81 - 325 mg/zi sau Warfarina (INR 2-3, tinta 2,5) |
|
|
Orice factor de risc inalt sau > 1 factor de risc moderat |
Warfarina (INR 2-3, tinta 2,5)a |
|
|
Factori de risc mic sau mai putin validati |
Factori de risc moderat |
Factori de risc inalt |
|
Sex feminin |
Varsta ≥ 75 ani |
AVC, AIT sau embolie in antecedente |
|
Varsta intre 65 - 74 ani |
Hipertensiunea |
Stenoza mitrala |
|
Boala coronariana |
Insuficienta cardiaca |
Proteze valvulare cardiacea |
|
Tireotoxicoza |
Fractia de ejectie a VS ≤ 35% |
|
|
|
Diabet zaharat |
|
a Pentru protezele valvulare raportul internationa normalizat (INR) tinta >/=2,5.
INR indica raportul internationa normalizat; VS, ventricul stang; AVC, accident vascular cerebral; AIT, accident ischemic tranzitor.
Riscul pentru trombemblism in cazul flutterului atrial nu este la fel de bine stabilit ca pentru FA, dar in general este estimat ca fiind mai mare decat acela al pacientilor cu ritm sinusal si mai mic decat al celor cu FA persistenta sau permanenta. Desi riscul trombembolic general asociat cu flutterul atrial poate fi intrucatva mai mic decat cel asociat cu FA (156), pare prudent sa se estimeze riscul prin utilizarea acelorasi criterii de stratificare pentru ambele aritmii pana cand mai multe date puternice vor fi disponibile.
Inainte de 1990, terapia antiotrombotica pentru prevenirea AVC-ului ischemic si emboliei sistemice la pacientii cu FA era limitata in special pentru cei cu boala cardiaca reumatismala sau proteze valvulare cardiace (23). Anticoagulare a fost de asemenea acceptata pentru pacientii care au avut AVC ischemic confirmat, pentru prevenirea recurentelor, dar era adesea intarziata din cauza evitarii transformarii hemoragice. Unii au recomandat anticoagularea pacientilor cu tireotoxicoza sau alte conditii asociate cu cardiomiopatii. De atunci, 24 trialuri randomizate implicand pacinenti cu FA nonvavulara au fost publicate, incluzand 20012 pacienti cu o urmarire medie de 1,6 ani, o expunere totala de aproape 32800 pacienti/an.
Cinci mari trialuri randomizate au evaluat anticoagularea orala in special pentru preventia primara a trombembolismului la pacientii cu FA nonvalvulara. (157-l63). (ura 4). Al saselea trial s-a concentrat asupra preventiei secundare a pacientilor care au supravietuit unui AVC neinvalidant sau AIT cerebral (164). Meta-analiza cu privire la principiul intentiei de a trata (intention to treat), a aratat ca anticoagularea orala in doza ajustata este foarte eficienta pentru preventia tuturor AVC-urilor (ischemic si hemoragic), cu o reducere a riscului de 61% (95% CI 47% la 71%) versus placebo (165) (.4). Durata de urmarire a fost in general intre 1 si 2 ani, cea mai lunga a fost 2,2 ani, in timp ce in practica clinica, necesitatea terapiei anticoagulante la pacientii cu FA se extinde pe perioade mult mai lungi de timp.
ura 4. Terapia antitrombotica pentru preventia AVC-ului (ischemic sau hemoragic) la pacientii cu fibrilatie atriala nonvalvulara. Terapia cu Warfarin ain doza ajustata ata cu Placebo (6 trialuri randomizate). Modificate cu permisiunea lui Hart RG, Benavente O., McBride R, et al. Terapia antitrombotica pentru preventia AVC-ului la pacientii cu fibrilatie atriala: o meta-analiza. Ann Intern Med 1999; 131: 492-501 (165). AFASAK indica Copenhagen Atrial Fibrillation, Aspirin, Anticoagulation; BAATAF, Boston Area Anticoagulation Trial for Atrial Fibrillation; CAFA, Canadian Atrial Fibrillation Anticoagulation; EAFT, European Atrial Fibrillation Trial; SPAF, Stroke prevention in Atrial Fibrillation; SPINAF,Stroke Prevention in Nonrheumatic Atrial Fibrillation.
Terapia cu warfarina in doza ajustata ata cu placebo
Reducerea riscului relativ
(95%IC)
Toate trialurile (n=6)
![]()
Mai bine cu Warfarina Mai rau cu warfarina
Toate trialurile raportate au exclus pacientii considerati la risc inalt de sangerare. Varsta pacientului si intensitatea anticoagularii sunt cei mai puternici predictori ai sangerarilor majore. (166-l69). Participantii trialurilor, cu o varsta medie de 69 de ani, au fost selectati si urmariti cu grija, si este neclar daca procentul de sangerari majore relativ mic observat, este valabil de asemenea, pentru pacientii cu FA din practica clinica, care au o varsta medie de aproape 75 de ani si terapie anticoagulanta mai putin bine controlata. Intensitatea tinta a anticoagularii implica o balanta intre preventia AVC-ului ischemic si evitarea complicatiilor hemoragice (ura 5). Obtinerea celei mai scazute dar eficiente intensitati a anticoagularii, care sa reduca la minimum riscul sangerarii, este importanta in special pentru pacientii varstnici cu FA. Protectia maxima pentru AVC-ul ischemic este obtinuta probabil, pentru un INR situat intre 2 si 3 (170). In ciuda anticoagularii unui numar mai mare de pacienti varstnici cu FA, procentele hemoragiilor intracerebrale sunt considerabil mai mici decat in trecut, intre 0,1 si 0,6 in rapoartele contemporane. Aceasta poate reflecta intensitatea mai scazuta a anticoagularii, reglarea mai atenta a dozei sau controlul mai bun al hipertensiunii (171-l73).
ura 5. Odd ratio ajustat pentru AVC-urile ischemice si sangerarile intracraniene in raport cu intensitatea anticoagularii. Modificat cu permisiunea Hylek EM, Singer DE. Factori de risc pentru hemoragiile intracraniene la pacientii tratatati cu warfarina in afara spitalului. Ann Intern Med 1994; 120:897-902 (166). Date obtinute de la Oden A, Fahlen M, Hart RG. INR optim pentru preventia AVC-ului si mortii in fibrilatia atriala: o apreciere critica. Thromb Res 2006; 117:493-9 (167).
AVC ischemic Sangerari intracerebrale![]()
![]()
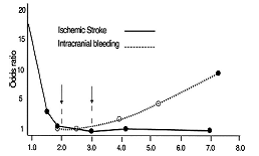
Aspirina ofera numai o protectie modesta impotriva AVC-ului ischemic pacientilor cu FA (157, 161, 164, 174-l80). Meta-analiza a 5 trialuri randomizate a aratat o reducere a AVC-ului de 19% (95% CI=2% la 34%) (165). Aspirina poate fi mai eficienta pentru pacientii cu FA care au hipertensiune si diabet (181) prin reducerea AVC-ului ischemic noncardioembolic versus cardioembolic la pacientii cu FA. (72). AVC-urile cardioembolice sunt in medie mai invalidante decat AVC-urile noncardioembolice (92). Aspirina pare sa previna mai bine AVC-urile noninvalidante decat AVC-urile invalidante (165). Astfel cu cat este mai mare riscul de AVC cardioembolic invalidant la pacientii cu FA, cu atat protectia oferita de aspirina este mai mica. (92).
Combinatiile anticoagulantelor orale si agentilor antiplachetari nu au aratat un risc hemoragic redus sau eficienta crescuta, fata de anticoagularea in doza ajustata singura. Combinand aspirina cu un anticoagulat oral la o intensitate mai mare poate accentua hemoragia intracerebrala, in special la pacientii varstnici cu FA (183). Pentru cei mai multi pacienti cu FA care au boala coronariana stabila, numai anticoagularea cu warfarina (INR tinta 2-3) ar trebui sa ofere o profilaxie antitrombotica satisfacatoare atat impotriva evenimentelor cerebrale cat si impotriva evenimentelor ischemice miocardice.
Terapia antiplachetara este in special valoroasa pentru preventia ischemiei miocardice recurente la pacientii cu interventie percutana coronarian, dar nici un studiu adecvat, care sa se refere la situatia acestor pacienti care necesita si anticoagulare cronica din cauza FA, nu a fost publicat. Consensul autorilor acestui ghid este ca agentul cel mai important pentru mentinerea patentei coronarelor si stenturilor este clopidogrelul derivat al tienopiridinelor si ca adaosul aspirinei la regimul anticoagulant cronic determina cresterea riscului si nu a beneficiului. Desi este necasara de obicei intreruperea sau reducerea anticoagularii pentru prevenirea sangerarilor la locul punctiei arterei periferice, antagonistii de vitamina K ar trebui sa fie reluati cat mai repede posibil dupa procedura si doza ajustata pentru obtinerea unui INR in limite terapeutice. Aspirina poate fi administrata temporar in timpul hiatusului, dar regimul de intretinere ar trebui apoi, sa se compuna din combinarea clopidogrelului 75mg zilnic si warfarina (INR 2-3) pentru 9-l2 luni, dupa care warfarina ar trebui continuata ca monoterapie in absenta unui eveniment coronarian ulterior.
Utilizarea heparinelor cu greutate moleculara mica in locul heparinei nefractionate la pacientii cu FA se bazeaza in mare masura pe extrapolarea de la situatiile cu tromboza venoasa profunda si de la studii limitate observationale (184). In general heparinele cu greutate moleculara mica au fata de heparina nefractionata cateva avantaje farmacologice. Acestea includ un timp de injumatatire mai lung, o biodisponibilitate mai predictibila (mai mare de 90% dupa injectia subcutana), clearance predictibil (permitand administrarea subcutana de o data sau doua ori pe zi) si un raspuns antitrombotic predictibil bazat pe greutatea corporala, care permite administrarea unei doze fixe fara monitorizarea in laborator, exceptie facand circumstantele speciale cum ar fi obezitatea, insuficienta renala si sarcina (185). Propietatile avantajoase ale heparinelor cu greutate moleculara mica pot simplifica tratamentul FA in situatiile acute si scurteaza sau elimina necesitatea internarii pentru initierea anticoagularii. Auto-administrarea heparinelor cu greutate moleculara mica in afara spitalului, de pacientii cu FA cu cardioversie electiva este o abordare promitatoare care poate determina reducerea cheltuielilor (186).
Intreruperea anticoagularii orale este necesara pentru pregatirea procedeelor chirurgicale elective. La pacientii cu proteze mecanice valvulare cardiace, in general este oportuna inlocuirea cu heparina nefractionata sau cu heparina cu greutate moleculara mica pentru a preveni tromboza (187). La pacientii cu FA care nu au proteze mecanice, avand in vedere incidenta trombembolismului la pacientii cu FA nonvalvulara, consensul Grupului de Scriitori este ca anticoagularea poate fi intrerupta pentru proceduri diagnostice sau terapeutice care au risc de sangerare, fara substituirea heparinei pentru o perioada pana la o saptamana. La pacientii cu risc inalt (in special cu AVC, AIT sau embolie sistemica in antecedente) sau cand o serie de proceduri necesita intreruperea anticoagularii orale pentru perioade mai lungi de timp, heparina nefractionata sau heparina cu greutate moleculara mica ar trebui administrate intravenos sau subcutanat.
ura 6 Terapia antitrombotica pentru preventia AVC-ului (ischemic sau hemoragic) la pacienrii cu fibrilatie atriala nonvalvulara: warfarina compatrata cu aspirina si aspirina ata cu placebo. Modificate cu permisiunea Hart RG, Benavente O, McBride R, Pearce LA. Terapia antitrombotica pentru preventia AVC-ului la pacientii cu fibrilatie atriala: o meta-analiza. Ann Inter Med 1999; 131:492-501 (165). AFASAK indica Copenhagen Atrial Fibrillation, Aspirin, Anticoagulation; EAFT, Eurpean A trial Fibrilation Trial; ESPS, European Stroke prevention study; LASAF, Low-Dose Aspirin, stroke, A trial Fibrilation; UK-TIA, United Kindom transient ischemic Attack Aspirin Trial; PATAF, Prevention of Arterial Thromboemlism in A trial fibrillation; SPAF, Stroke prevention in Atrial Fibrillation; SPINAF, Stroke Prevention in Nonrheumatic Atrial Fibrillation
Compararea apirinei cu Placebo
Compararea Warfarinei cu Placebo Reducerea riscului relativ
Reducerea riscului relativ (95% IC)
(95% IC)
Toate trialurile(n=6) Toate trialurile (n=5)
![]()
![]()
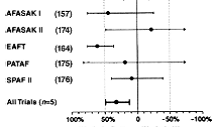
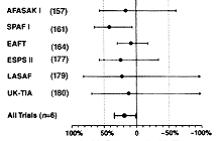
O optiune ce a iesit in evidenta pentru pacientii cu fibrilatie atriala, care nu pot tolera fara riscuri anticoagularea, care inca nu este suficient investigata astfel incat sa permita aplicarea clinica generala, este obliterarea urechiusii AS care indeparteaza principalul loc al formarii trombilor (188). In afara de amputarea directa chirurgicala sau reducerea urechiusii, cateva metode sunt in curs de dezvolatare pentru a obtine aceasta prin abord intravascular cu cateter sau transpericardic (189). Eficinta acestei tehnici este probabil legata de eliminarea completa si permanenta a fluxului sangvin de la nivelul urechiusii AS. Aceasta a fost demonstrata prin ecografia transesofagiana in momentul interventiei, dar viabilitatea acestui efect nu a fost confirmata prin examinari ulterioare dupa cativa ani. Ramane sa se demonstreze daca masurile mecanice proiectate sa previna embolia materialului trombotic din urechiusa AS se vor dovedi abil eficiente si mai sigure decat anticoagularea pentru unii pacienti (190).
Cardioversia poate fi efectuata la alegere pentru restabilirea ritmului sinusal la pacientii cu FA persistenta. Necesitatea cardioversiei poate fi imediata cand aritmia este factorul principal responsabil pentru insuficienta cardiaca acuta, hipotensiune sau agravarea anginei pectorale la pacientii cu boala coronariana. Totusi, cardioversia aduce un risc pentru trombembolism daca anticoagularea profilactica nu este initiata inaintea procedurii, si acest risc este cel mai mare cand aritmia este prezenta de mai mult de 48 de ore.
Cardioversia poate si realizata cu medicamente sau soc electric. Medicamentele sunt folosite de obicei inaintea conversiei electrice directe, aceasta devenind o procedura standard. Dezvoltarea noilor medicamente a crescut popularitatea conversiei farmacologice, dar dezavantajele includ torsadele de varfuri induse de medicamente sau alte aritmii serioase. In plus, cardioversia farmacologica este mai putin eficienta decat cardioversia electrica directa cand este folosit soc bifazic. Dezavantajul cardioversiei electrice este necesitatea sedarii sau anesteziei, pe care cardioversia farmacologica nu o cere. Nu sunt evidente ca riscul trombembolismului sau AVC-ului difera intre metodele de cardioversie farmacologica sau electrica. Recomandarile pentru anticoagulare sunt aceleasi pentru ambele metode, cum este subliniat in sectiunea I.C.2, Prevenirea Trombembolismului. Cardioversia pacientilor cu FA dupa interventie chirurgicala cardiaca recenta sau dupa infarct miocardic este prezentata ulterior. ( Sectiunea I.C.5, Consideratii Speciale).
Tabelul 11. Recomandari pentru cardioversia fibrilatiei atriale cu durata mai scurta de 7 zile.
|
Medicamenta |
Cale de administrare |
Clasa de recomandare |
Nivel de do |
Referinte |
|
Agenti cu eficienta dovedita |
||||
|
Dofetilid |
Oral |
I |
A |
|
|
Flecainida |
Oral sau iv. |
I |
A |
|
|
Ibutilid |
iv. |
I |
A |
|
|
Propafenona |
Oral sau iv. |
I |
A |
|
|
Amiodarona |
Oral sau iv. |
IIa |
A |
|
|
Agenti mai putin eficienti sau incomplet studiati |
||||
|
Disopiramida |
iv. |
IIb |
B |
|
|
Procainamida |
Iv, |
IIb |
B |
|
|
Chinidina |
Oral |
IIb |
B |
|
|
Nu ar trebui administrati |
||||
|
Digoxin |
Oral sau iv. |
III |
A |
|
|
Sotalol |
Oral sau iv. |
III |
A |
|
a Dozele medicamentelor folosite in aceste studii pot sa nu fie aceleasi cu cele recomandate de producatori. Medicamentele sunt listate in ordine alfabetica fiecare cu nivelul de recomandare si clasa de evidenta.
Calitatea evidentelor disponibile care sa masoare eficienta cardioversiei farmacologice este limitata de esantioane mici, absenta criteriilor standard de includere (multe studii includ atat pacienti cu FA cat si pacienti cu flutter atrial), intervale diferite de la administrarea medicamentelor la evaluarea rezultatelor si selectarea arbitrara a dozelor. Desi conversia farmacologica si cea electrica nu au fost ate direct, abordarea farmacologica pare mai simpla dar este mai putin eficienta. Riscul major este legat de toxicitatea medicamentelor antiaritmice. In realizarea acestor ghiduri, trialuri placebo-controlate ale cardioversiei farmacologice, in care medicamentele erau administrate pentru o perioada scurta de timp, in mod specific pentru restabilirea ritmului sinusal au fost subliniate. De asemenea au fost luate in considerare trialuri in care grupul control a primit alt medicament antiaritmic.
Tabelul 12. Recomandari
pentru cardioversia farmacologica
a fibrilatiei atriale cu durata mai lunga de 7 zile.
|
Medicamenta |
Cale de administrare |
Clasa de recomandare |
Nivel de do |
Referinte |
|
Agenti cu eficienta dovedita |
||||
|
Dofetilid |
Oral |
I |
A |
|
|
Amiodarona |
Oral sau iv. |
IIa |
A |
|
|
Ibutilid |
iv. |
IIa |
A |
|
|
Agenti mai putin eficienti sau incomplet studiati |
||||
|
Disopiramida |
iv. |
IIb |
B |
|
|
Flecainida |
oral |
IIb |
B |
|
|
Procainamida |
Iv. |
IIb |
C |
|
|
Propafenona |
Oral sau iv. |
IIb |
B |
|
|
Chinidina |
Oral |
IIb |
B |
|
|
Nu ar trebui administrati |
||||
|
Digoxin |
Oral sau iv. |
III |
B |
|
|
Sotalol |
Oral sau iv. |
III |
B |
|
aDozele medicamentelor folosite in aceste studii pot sa nu fie aceleasi cu cele recomandate de producatori. Medicamentele sunt listate in ordine alfabetica fiecare cu nivelul de recomandare si clasa de evidenta.
ura 7. Managementul pacientilor cu fibrilatie atriala nou descoperita (FA). Vezi*ura 9, IC indica insuficienta cardiaca.
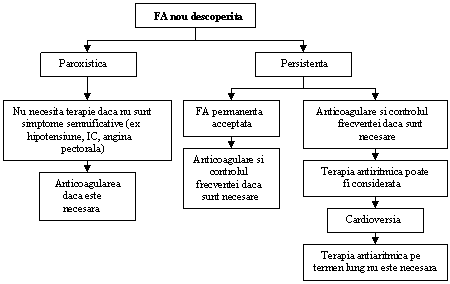
Cardioversia farmacologica pare cea mai eficienta cand este initiata in 7 zile de la debutul episodului de FA (191, 192). Cea mai mare parte a acestor pacienti au primul episod de FA documentat sau un pattern necunoscut al FA la momentul tratamentului. (Vezi Sectiunea III, Clasificarea). O mare proportie a pacientilor cu FA cu debut recent se convertesc spontan in 24-48 de ore (193). Conversia spontana este mai putin frecventa la pacientii cu FA cu durata mai mare de 7 zile, si la fel si eficienta cardioversiei farmacologice este considerabil redusa la acesti pacienti. Cardioversia farmacologica poate accelera restabilirea ritmului sinusal la pacientii cu FA cu debut recent dar avantajul fata de placebo este modest dupa 24-48 de ore, terapia medicamentoasa este mult mai putin eficienta la pacientii cu FA persistenta. Cateva medicamente au debut intarziat al actiunii, si conversia poate sa apara dupa cateva zile de la initierea tratamentului (194). Tratamentul medicamentos a scurtat intervalul pentru cardioversie at cu placebo in cateva studii fara afectarea proportiei de pacienti care au ramas in ritm sinusal dupa 24 de ore (195). O problema posibila este interactiunea medicamentelor antiaritmice cu anticoagulantele orale antagonisti ai vitaminei K, crescand sau scazand efectul anticoagulant cand aceste medicamente sunt adaugate sau retrase din regimul de tratament. Problema este amplificata cand anticoagularea este initiata in pregatirea cardiovesiei elective. Adaugarea unui medicament antiaritmic pentru cresterea probabilitatii ca ritmul sinusal sa fie restabilit si mentinut poate perturba intensitatea anticoagularii dincolo de limitele terapeutice intentionate, crescand riscul sangerarilor sau complicatiilor trombembolice.
Un rezumat al recomandarilor privind utilizarea agentilor farmacologici si dozele recomandate sunt prezentate in Tabelele 11, 12 si 13. Algoritmurile pentru managementul farmacologic al FA sunt date in urile 7, 8, 9 si 10. In tot acest document este facuta referirea la clasificarea Vaughan Williams a medicamentelor antiaritmice (196), modificata astfel incat sa includa medicamentele care au devenit disponibile dupa ce clasificarea originala a fost facuta (Tabel 14). Recomandarile date in acest document sunt bazate pe datele publicate si nu adera in mod necesar la regulamentul si cerintele consemnate ale agentiilor guvernamentale. Aceste medicamente antiaritmice au fost aprobate pentru utilizarea clinica de agentiile federale de reglementare in Statele Unite si/sau Europa, dar utilizarea pentru tratamentul FA nu a fost aprobat in toate cazurile. In plus nu toate medicamentele au fost aprobate pentru utilizare in toate tarile.
Au fost identificate 36 studii clinice controlate evaluand 7 medicamente antiaritmice pentru mentinerea ritmului sinusal la pacientii cu FA paroxistica sau persistenta, 14 studii clinice controlate pentru profilaxia medicamentoasa implicand pacienti cu FA paroxistica si 22 studii clinice pentru profilaxia medicamentoasa pentru mentinerea ritmului sinusal la pacientii cu FA persistenta. Datele ative nu sunt suficiente astfel incat sa permita subclasificarea in functie de medicament sau etiologie. Medicamente si doze specifice pentru mentinerea ritmului sinusal sunt date in Tabelul 15. Ar trebui notat ca oricare agent activ la nivelul mambranei poate cauza proaritmie.
O problema frecventa legata de cardioversia farmacologica a FA este daca initierea tratamentulului antiaritmic se face in spital sau in afara spitalului. Preocuparea majora este posibilitatea efectelor adverse serioase incluzand torsada de varfuri. De fapt toate studiile cardioversiei farmacologice, cu exceptia celor care implica doze mici de amiodarona administrate pe cale orala, au interesat pacienti internati. Un studiu (251) a dovedit o abordare clinica utila cu conversia controlata de pacienti in afara spitalului folosind medicamente clasa IC.
Strategia pilula din buzunar consta in auto-administrarea unei singure doze pe cale orala a medicamentului imediat dupa debutul FA simptomatice imbunatatind calitatii vietii, scazand spitalizarile si reducerea costurilor (252). Recomandarile pentru initierea in afara spitalului sau administrarea intermitenta a medicamentelor antiaritmice difera pentru pacientii cu FA paroxistica sau persistenta. La pacientii cu FA paroxistica scopurile sunt terminarea episodului si prevenirea recurentelor. La pacientii cu FA persistenta scopurile sunt obtinerea cardioversiei farmacologice a FA, inlaturarea necesitatii cardioversiei electrice, sau cresterea succesulului cardioversiei electrice, prin scaderea pragului defibrilarii si previnirea recurentele precoce ale FA.
Tabelul 13 Dozele recomandate pentru medicamentele dovedite eficiciente pentru cardioversia farmacologica a fibrilatiei atriale.
|
Medicamenta |
Cale de administrare |
Dozab |
Reactii adverse potentiale |
Referinte |
|
|
Amiodarona |
Oral |
Spital: 1,2 - 1,8 g/zi in doze divizate pana la un total de 10 g, apoi 200 400 mg/zi doza de intretinere sau 30 mg/kgc doza unica. Ambulator: 600 - 800 mg/zi in doze divizate pana la un total de 10 g, apoi 200 400 mg/zi doza de intretinere |
Hipotensiune, bradicardie, alungire QT, torsada varfurilor (rar), tulburari gastrointestinale, constipatie, flebite (iv) |
|
|
|
Intravenos/oral |
5 7 mg/kgc in 30 60 minute, apoi 1,2 1,8 g/zi administrare iv continua sau in doze divizate pana la un total de 10 g, apoi 200 400 mg/zi doza de intretinere |
||||
|
Dofetilid |
Oral |
Clearance creatinina (ml/min) > 60 < 20 |
Doza (mcg BID) contraindicat |
Alungire QT, torsada varfurilor; doza se ajusteaza la functia renala, greutate si varsta |
|
|
Flecainida |
Oral |
200 300 mgc |
Hipotensiune, flutter atrial cu frecventa ventriculara rapida |
|
|
|
Intravenos |
1,5 3 mg/kgc in 10 20 minutec |
||||
|
Ibutilid |
Intravenos |
1 mg in 10 minute, se poate repeta administarea la nevoie |
Alungire QT, torsada varfurilor |
|
|
|
Propafenona |
Oral |
600 mg |
Hipotensiune, flutter atrial cu frecventa ventriculara rapida |
|
|
|
Intravenos |
1,5 2 mg/kgc in 10 20 minutec |
||||
|
Chinidinad |
Oral |
0,75 - 1,5 g in doze divizate la 6 12 ore, asociata cu medicamente bradicardizante |
Alungire QT, torsada varfurilor, tulburari gastrointestinale, hipotensiune |
|
|
a medicamentele sunt ordonate alfabetic
b dozele din tabel pot fi diferite de cele recomandate de producatori
c date insuficinete pentru a recomanda un anumit regim de incarcare pentru pacientii cu BCI sau disfunctie VS, la care aceste medicamente trebuie folosite cu prudenta sau deloc
d incarcarea cu chinidina pentru conversia fibrilatiei atriale este controversatasi tabelul prezinta metode mai sigure. Chinidina trebuie utilizata cu multa precautie.
BID, de doua ori pe zi; iv, intravenos
Tabelul 14. Clasificarea Vaughan Williams a medicamentelor antiaritmice
|
Clasa IA Disopiramida Procainamida Chinidina Clasa IB Lidocaina Mexiletina Clasa IC Flecainida Propafenona Clasa II Betablocante (ex. Propranolol) Clasa III Amiodarona Bretiliu Dofetilid Ibutilid Sotalol Clasa IV Bolcante ale canalului de calciu nondihidropiridinice (verapamil, diltiazem) |
Tabelul include compusii introdusi dupa publicarea clasificarii originale. Modificata cu permisiunea Vaughan Williams EM. O clasificare a actiunii antiaritmicelor reevaluata dupa o decada de noi droguri. J. Clin. Pharmacol 1984; 24:129-47 (196)
ura 8. Managementul farmacologic al pacientilor cu fibrilatie atriala paroxistica recurenta (AF).*Vezi ura 9. AAR indica antiaritmice
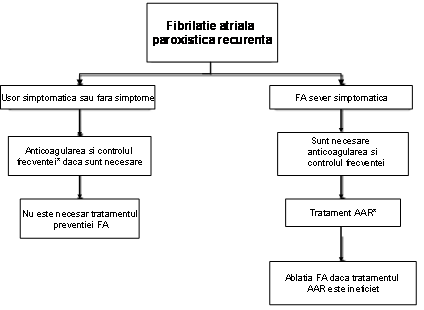
ura 9. Terapia antiaritmica pentru mentinerea ritmului sinusal la pacientii cu fibrilatie atriala paroxistica recurenta sau persistenta. In fiecare caseta medicamentele sunt in ordine alfabetica si nu in ordinea sugerata. Pe verticala este indicata ordinea de preferat pentru fiecare situatie. Gravitatea bolilor cardiace creste de la stanga la dreapta, si selectarea terapiei pentru pacientii cu mai multe conditii asociate depinde de conditia cea mai serioasa prezenta. Vezi sectiunea 8.3.3.3. in forma completa a ghidului pentru detalii. HVS indica hipertrofie ventriculara stanga.
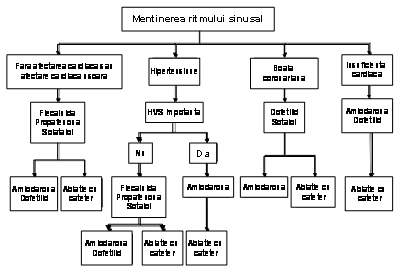
Tabelul 15. Dozele uzuale ale medicamentelor folosite pentru
mentinerea ritmului sinusal la pacientii cu fibrilatie atriala*.
|
Medicamentb |
Doza zilnica |
Reactii adverse |
|
Amiodaronac |
100 400 mg |
Fotosensibilitate, toxicitate pulmonara, polineuropatie, tulburari GI, bradicardie, rar torsada varfurilor, toxicitate hepatica, distiroidie, complicatii oculare |
|
Disopiramida |
400 750 mg |
Torsada varfurilor, IC, glaucom, retentie acuta de urina, uscaciunea mucoasei bucale |
|
Dofetilidd |
500 1000 mg |
Torsada varfurilor |
|
Flecainida |
200 300 mg |
Tahicardie ventriculara, IC, transformare in flutter atrial cu transmitere AV rapida |
|
Propafenona |
450 900 mg |
Tahicardie ventriculara, IC, transformare in flutter atrial cu transmitere AV rapida |
|
Sotalold |
160 -320 mg |
Torsada varfurilor, IC, bradicardie, exacerbarea BPCO |
aMedicamentele si dozele sunt rezultatul unui conses bazat pe studii publicate
bMedicamentele sunt ordonate alfabetic
cIncarcarea se face cu 600 mg/zi po timp de o luna sau cu 1000 mg/zi po timp de o saptamana
dPe perioada spitalizarii dozele trebuie ajustate la functia renala si urmarit efectul pe intervalul QT
La pacientii cu FA izolata fara boala cardica structurala, clasa IC poate fi initiata in afara spitalului. Pentru alti pacienti selectati fara disfunctie de nod sinusal sau de nod AV, bloc de ramura, interval QT prelungit, sindrom Brugada sau boala cardica structurala, administrarea propafenonei si flecainidei sub forma strategiei pilula din buzunar in afara spitalului devine o optiune odata ce tratamentul a fost dovedit ca fiind in siguranta in spital, avand in vedere relativa siguranta (absenta toxicitatii de organ si incidente putine ale proaritmiei estimate) (253-255). Cu toate acestea, inainte ca acesti agenti sa fie initiati este in general recomadata administrarea beta blocantilor sau antagonistilor canalelor de calciu nondihidropiridine, pentru prevenirea conducerii AV rapide in eventualitatea instalarii flutterului atrial (256, 257). Daca conducerea nodului AV nu este alterata, beta blocanti sau antagonisti ai canalelor de calciu nondihidropiridine cu actiune scurta ar trebui administrate cu cel putin 30 de minute inaintea administrarii antiaritmicelor clasa IC pentru terminarea episodului acut de FA, sau agenti care sa blocheze nodul AV ar trebui prescrisi ca terapie continua de fond. Deoarece terminarea FA paroxistice se poate asocia cu bradicardie determinata de disfunctia de nod sinusal sau AV, o incercare de conversie ar trebui facuta initial in spital, inainte ca pacientul sa fie declarat potrivit pentru utilizarea in afara spitalului a propafenonei sau flecainidei sub forma pilula din buzunar, pentru conversia recurentelor ulterioare ale FA. Tabelul 16 specifica alti factori asociati cu toxicitatea proaritmica a agentilor clasa IC. Este de notat ca acestia includ sexul feminin.
Tabelul 16. Conditii care predispun la proaritmie ventriculara
|
Antiaritmice clasa IA si clasa III VW |
Antiaritmice clasa IC VW |
|
Interval QT lung (QTc ≥ 460 ms) Sindrom QT lung Boala cardiaca structurala, HVS semnificativa Disfunctie VSa Hipopotasemie/hipomagneziemiea Genul feminin Disfunctia renalaa Bradicardiea Boala de nod sinusal sau bloc AV induse de medicamente Conversia (medicamentoasa) a FA la ritm sinusal Ectopie insotita de cicluri R R scurt lung Cresterea rapida a dozei Doze mari (Sotalol, Dofetilid), acumularea antiaritmicului in organisma Interactiuni cu alte medicamentea Diuretice Alte antiaritmice care prelungesc QT Medicamente neantiaritmice enumerate la https://www.torsades.org/ Proaritmie in antecedente Dupa initierea medicamentului Alungire excesiva a QT |
ORS larg (> 120 ms) TV concomitenta Boala cardiaca structurala Disfunctie VSa Raspuns ventricular rapida In timpul efortului In timpul conducerii AV rapide Cresterea rapida a dozei Doze mari, acumularea antiaritmicului in organisma Interactiuni cu alte medicamentea Inotrop negative Largire excesiva a QRS (> 150% |
aUnele dintre aceste condittii pot aparea tardiv dupa introducerea antiaritmicului. Vezi sectiunea 8.3.3.3 din ghidul detaliat. Clasificarea Vaughan Williams (VW) a antiaritmicelor dupa Vaughan Williams EM. A classification of antiarrhythmic actions reassessed after a decade of new drugs. J Clin Pharmacol 1984; 24: 129 47.196
FA, fibrilatie atriala; AV, atrioventricular; VS, ventricul stang, HVS, hipertrofie ventriculara stanga; QTc, interval QT corectat; TV, tahicardie ventriculara.
Cateva date prospective sunt disponibile cu privire la siguranta relativa a initierii terapiei antiaritmice in afara spitalului versus in spital, si decizia de a initia terapia in afara spitalului ar trebui sa fie cu grija, individualizata. Abordarea pilula din buzunar pare realizabila si sigura pentru pacienti selectati cu FA, dar siguranta acestei abordari fara evaluarea initiala in spital ramane nesigura.
Atat timp cat intervalul QT bazal necorectat este mai mic de 460ms, electrolitii serici sunt normali, factorii de risc asociati cu proaritmia indusa de drogurile clasa III sunt luati in considerare (tabel 16), sotalolul poate fi initiat in afara spitalului la pacientii cu boala cardiaca usoara sau fara boala cardiaca. Cel mai sigur este sa incepi sotalolul cand pacientul este in ritm sinusal. Amiodarona poate fi de asemenea administrata in siguranta in afara spitalului, chiar la pacientii cu FA persistenta, deoarece ea determina deprimarea minima a functiei miocardului si are potential proaritmic mic (258), dar administrarea dozei de incarcare in spital poate fi necesara pentru restabilirea mai rapida a ritmului sinusal la pacientii cu insuficienta cardiaca sau alte forme de compromitere hemodinamica legate de FA. Regimul de incarcare in mod caracteristic necesita administrarea a 600mg zilnic pentru 4 saptamani (258) sau 1g zilnic pentru o saptamana (232), urmat de doze mici de intretinere. Amiodarona, agentii clasa IA si IC, sotalolul pot fi asociate cu bradicardie care sa necesite imtarea pacemaker-ului permanent (259); aceasta este mai frecventa pentru amiodarona si bradicardia asociata cu amiodarona este mai frecventa la femei decat la barbati. Chinidina, procainamida si disopiramida nu ar trebui incepute in afara spitalului si initierea dofetilidei in afara spitalului nu este permisa in prezent. Monitorizarea transtelefonica sau prin alte metode de supraveghere ECG pot fi utilizate pentru monitorizarea ritmului cardiac si conducerii cardiace odata ce terapia antiaritmica farmacologica a fost initiata la pacientii cu FA. In mod specific ar trebui sa fie masurate intervalul PR (cand sunt folosite flecainida, propafenona, sotalolul sau amiodarona), durata complexului QRS (cu flecainida sau propafenona), intervalul QT (cu dofetilid, sotalol, amiodarona sau disopiramida).
Ca o regula generala medicamentele antiaritmice ar trebui incepute la o doza relativ mica si dozate in functie de raspuns, iar ECG-ul ar trebui sa fie reevaluat dupa fiecare modificare a dozei. Frecventa cardiaca ar trebui sa fie monitorizata la interval de aproximativ o saptamana, atat prin verificarea frecventei pulsului prin folosirea unui dispozitiv de inregistrare a evenimentelor cat si prin inregistrarea ECG obtinuta la oficiu. Doza altor medicamente pentru controlul ritmului ar trebui sa fie redusa cand frecventa scade dupa initierea amiodaronei si oprite daca frecventa scade excesiv. Terapiile medicamentoase administrate concomitent ar trebui sa fie atent monitorizate, si atat pacientul cat si medicul ar trebui sa fie preveniti de interactiunile daunatoare posibile. Doza de digoxin si warfarina, in special ar trebui de obicei reduse in momentul initierii amiodaronei, anticipand cresterea nivelelor serice ale digoxinei si INR-ului, care apar in mod caracteristic.
Conversia electrica presupune eliberarea unui soc electric sincronizat cu activitatea intrinseca a inimii prin sensing-ul undei R pe ECG, astfel incat stimularea electrica sa nu se produca in timpul perioadei vulnerabile a ciclului cardiac.136 Conversia electrica este folosita pentru toate ritmurile anormale cu exceptia fibrilatiei ventriculare. Defibrilarea presupune o descarcare asincrona, care este potrivita in fibrilatia ventriculara deoarece in acest caz nu se poate face sincronizarea cu unda R.
Reusita conversiei depinde de boala cardiaca de fond si de intensitatea curentului folosit. Conversia se poate face folosind electrozi externi sau interni. Desi ultima metoda este mai eficienta la pacientii obezi sau cu boala pulmonara obstructiva, nu este folosita pe scara larga. Frecventa recurentelor fibrilatiei atriale nu difera intre cele doua metode.135,260 Cardioversia trebuie facuta cu pacientul anesteziat si nemancat. Anestezicele cu durata scurta de actiune si cele care produc sedare constienta sunt preferate pentru ca permit recuperarea rapida dupa procedura, spitalizarea pe timpul noptii fiind rareori necesara.
Socul electric se sincronizeaza cu unda R de pe o derivatie ECG selectata care arata clar si activitatea atriala, permitand monitorizarea. La 64 de pacienti alesi intamplator pentru soc monofazic cu energii de 100, 200 sau 360 J, folosirea de energii mari initial a fost mai eficienta decat energiile joase (rata imediata de succes 14% cu 100J, 39% cu 200 J si 95% cu 360 J), astfel incat la cei la care s-au folosit initial 360 de J numarul de socuri si energia cumulata au fost mai mici.262 Aceste date arata ca socul monofazic de 100 J este adesea insuficient pentru conversia fibrilatiei atriale si de aceea folosirea unei energii initiale de 200 J este recomandata.
ura 10. Managementul farmacologic al pacientilor cu fibrilatie atriala (FA) persistenta recurenta sau permanenta. *Vezi ura 9. Initierea terapiei medicamentoase inaintea cardioversiei pentru reducerea probabilitatii recurentelor precoce ale FA.
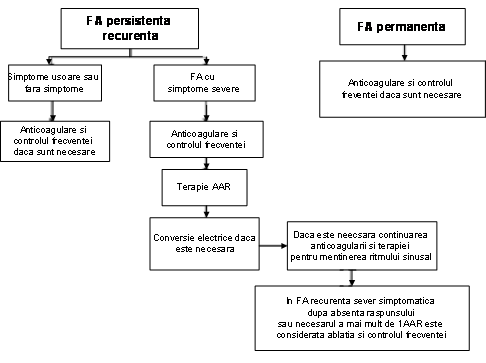
Socul initial de 200 J este recomandat si cand se folosesc unde bifazice, mai ales atunci cand se doreste conversia unei fibrilatii de lunga durata.263
Conversia electrica a fibrilatiei atriale se poate face si la pacientii cu stimulatoare cardiace sau defibrilatoare imtabile, cu anumite precautii. Stimulatoarele si defibrilatoarele imtabile sunt proiectate astfel incat sa fie protejate de descarcarile electrice externe, insa datele programate pot fi modificate de socurile externe. Curentul electric condus prin electrozii imtati poate provoca leziuni endocardice cu cresterea temporara sau permanenta a pragului de stimulare si lipsa capturii ventriculare. Pentru a asigura o functionare normala a dispozitivelor imtabile, acestea trebuie interogate si, daca este cazul, reprogramate inainte si dupa conversia electrica.
Riscurile conversiei electrice sunt trombembolismul si aritmiile. Accidentele embolice au fost raportate la 1-7% din pacientii la care nu a fost administrata anticoagulare profilactica inaintea cardioversiei.264,265 Terapia antitrombotica profilactica este prezentata in sectiunea VII.B.5.c, Terapia farmacologica ajduvanta conversiei electrice.
Desi majoritatea recurentelor fibrilatiei atriale apar in prima luna dupa conversia electrica, cercetarile efectuate cu conversie atriala interna270 si studiile postconversie cu socuri transtoracice271 au aratat ca exista mai multe tipuri de recurenta a fibrilatiei atriale. (ura 7) Uneori, dupa socul electric extern nu apare nicio bataie sinusala sau ectopica, din cauza unui prag de defibrilare atriala crescut. Alteori, fibrilatia atriala reapare dupa o perioada de cateva minute de ritm sinusal272si recurenta dupa cardioversie dureaza zile sau saptamani.271 Esecul total al socului electric extern si recurenta imediata apar la aproximativ 25% din pacienti, iar recurentele subacute apar intr-un procent egal in aproximativ 2 saptamani.273
Restabilirea si mentinerea ritmului sinusal sunt mai putin probabile la pacientii cu o durata a fibrilatiei atriale mai mare de un an decat la cei cu debut recent. Succesul imediat al conversiei electrice variaza intre 70% si 90% in datele din literatura.262,274-276 Aceasta variatie ar putea fi explicata de diferentele intre caracteristicile pacientilor inclusi si tipul undelor folosite, dar depinde si de definitia succesului, rezultatele fiind evaluate la intervale de minute sau zile. Ritmul sinusal poate fi restabilit la mare parte din pacienti, dar rata recurentelor este mare fara medicatie antiaritmica. Adaugarea medicatiei antiarimice la conversia electrica creste sansele de succes (prin scaderea pragului de conversie) si contribuie la preveniea recurentelor. Medicatia antiaritmica poate fi initiata in ambulator sau in spital inaintea cardioversiei. Riscurile tratamentului farmacologic sunt: cresterea paradoxala a pragului de defibrilare (flecainida277), cresterea frecventei ventriculare atunci cand antiaritmicele de clasa IA sau IC sunt administrate fara blocante ale nodului AV,256,257,278,279 si inducerea aritmiilor ventriculare (Tabelul 17). Pacientii cu fibrilatie atriala de scurta durata, fara o alta boala cardiaca de fond, sunt mai putin predispusi la recurente precoce decat cei cu afectare cardiaca si cu aritmie de durata mai lunga. Acestia din urma par a beneficia mai mult de administrarea profilactica a medicatiei antiaritmice. Pretratamentul cu agenti farmacologici este util la pacientii care nu raspund la conversia electrica si la cei cu recurenta imediata sau subacuta. Pretratamentul este optional la cei cu recurente tardive sau la prima tentativa de conversie a fibrilatei atriale persistente. A doua tentativa de conversie cu tratament farmacologic adjuvant este recomandata mai ales in cazul recurentelor precoce. Alte incercari de conversie, dupa o a doua nereusita, au valoare limitata. Conversii repetate, nu foarte frecvente, sunt acceptate la pacientii intens simptomatici la aparitia recurentelor.
Tratamentul farmacologic, in doze care sa asigure concentratii plasmatice eficiente inaintea conversiei, creste sansele de succes imediat si suprima recurentele precoce. Dupa conversia la ritm sinusal, in cazul administrarii antiaritmicelor care prelungesc intervalul QT, pacientii trebuie monitorizati in spital 24-48 de ore pentru urmarirea frecventei cardice si pentru a permite interventii precoce in cazul aparitiei torsadei varfurilor (Tabelul 18). Studiile randomizate in care a fost utilizat Ibutilid ca pretratament au aratat o rata mai mare de conversie ativ cu pacientii din grupul control, iar dupa o prima tentativa nereusita, Ibutilidul creste sansele de conversie. 280,281
Tabelul 17. Tipuri de
proaritmie aparute in timpul tratamentului FA sau
flutter-ului atrial cu diverse antiaritmice conform clasificarii Vaughan
Williams
|
A. Proaritmie ventriculara Torsada varfurilor (antiaritmice clasa IA si IIIa VW) Tahicardie ventriculara monomorfa sustinuta (de obicei antiaritmice clasa IC VW) Tahicardie ventriculara polimorfa sustinuta/fibrilatie ventriculara fara QT lung (antiaritmice clasa IA, IC si III VW) B. Proaritmie atriala Inducerea recurentelor (probabil antiaritmice clasa IA, IC si III VW) Transfomarea FA in flutter atrial (de obicei antiaritmice clasa IC VW) Cresterea pragului de defibrilare (problema potentiala a antiaritmicelor clasa IC VW) C. Tulburari ale formarii si conducerii impulsului Accelerarea frecventei ventriculare in timpul FA (antiaritmice clasa IA si IC VW) Conducere rapida pe cale accesorie (Digoxin, Verapamil intravenos sau Diltiazemb) Disfunctie de nod sinusal, bloc atrioventricular (aproape toate antiaritmicele) |
aComplicatie rara a amiodaronei
bDesi potentarea conducerii pe calea accesorie este discutabila in cazul betablocantelor, trebuie avut grija in cazul administrarii acestor medicamente la pacientii cu FA asociata cu preexcitatie. Clasificarea Vaughan Williams (VW) a antiaritmicelor dupa Vaughan Williams EM. A classification of antiarrhythmic actions reassessed after a decade of new drugs. J Clin Pharmacol 1984; 24: 129 47.196
Nu exista studii randomizate cu tratament antitrombotic la pacientii cu fibrilatie sau flutter atrial la care se face conversie, dar in seriile caz-control riscul de embolie a fost intre 1% si 5% .265,282 Riscul a fost spre limita inferioara atunci cand s-a administrat anticoagulant (cu mentinerea INR intre 2 si 3) timp de 3-4 saptamani inainte si dupa conversie.62,269 Tratamentul anticoagulant se administreaza in mod curent la pacientii cu fibrilatie atriala cu durata mai mare de 2 zile atunci cand se decide tentarea conversiei. Manning si colaboratorii283 au sugerat ca pacientii la care nu se deceleaza tromb in US la TEE nu necesita anticoagulare, dar cercetarile 284 si metaanalizele ulterioare nu au sustinut aceasta ipoteza.285
Presupunand ca majoritatea accidentelor vasculare cerebrale la pacientii cu fibrilatie atriala sunt datorate formarii trombilor in US ca urmare a stazei, atunci restabilirea si mentinerea ritmului sinusal ar reduce riscul de embolie. Nu exista insa do ca mentinerea ritmului sinusal reduce episoadele embolice. Conversia AF la ritm sinusal este urmata de o disfunctie mecanica tranzitorie a AS si US 286 care poate aparea dupa conversia spontana, farmacologica 287,288 sau electrica a FA 288-290 sau dupa ablatia cu radiofrecventa a flutterului atrial.91 Perioada de recuperare a functiei mecanice este influentata si de durata episodului de FA.291-293
Aceasta ar putea fi o explicatie a episoadelor embolice la pacientii fara tromb in AS la TEE efectuata inaintea conversiei.284 Trombul se formeaza in perioada de disfunctie mecanica tranzitorie a AS iar, odata cu recuperarea functiei contractile, trombul este expulzat, explicand de ce majoritatea emboliilor apar in primele 10 zile dupa conversie.84
Atunci cand la TEE se identifica tromb in US riscul de embolie este crescut si pacientii necesita anticoagulare cel putin 3 saptamani inainte si 4 saptamani dupa conversia farmacologica sau electrica. Intr-un studiu multicentric, 1222 de pacienti cu FA persistenta mai mult de 2 zile sau flutter atrial si FA in antecedente 294 au fost randomizati pentru strategie conventionala sau TEE ghidata. In grupul cu TEE, conversia a fost amanata la pacientii cu tromb si s-a administrat warfarina 3 saptamani cu repetarea TEE pentru confirmarea disparitiei trombului. S-a administrat heparina o perioada scurta inaintea conversiei si apoi warfarina timp de 4 saptamani dupa conversie. Pacientii din celalalt grup au fost anticoagulati 3 saptamani inainte si 4 saptamani dupa conversie fara control TEE. Ambele metode au avut un risc mic, abil, de accident vascular cerebral (0,81% la cei cu TEE si 0,50% la cei cu tratament conventional) dupa 8 saptamani si nu au fost diferente semnificative in ceea ce priveste rata de succes a conversiei si riscul de sangerari majore. Beneficiul TEE a fost de scurtare a perioadei pana la conversie.
La pacientii cu durata a FA mai mare de 48 de ore sau necunoscuta se recomanda anticoagulare 3 saptamani inainte si 4 saptamani dupa conversie. Necesitatea anticoagularii este mai putin statuata la pacientii cu FA de durata mai scurta, desi, si in aceste cazuri, apar episoade embolice sau trombi in AS. Atunci cand FA acuta produce decompensare hemodinamica manifestata prin angina pectorala, IM, soc sau edem pulmonar este necesara conversia imediata, fara a fi intarziata de anticoagularea terapeutica. In aceste situatii se administreaza intravenos heparina nefractionata sau heparina fractionata subcutan inaintea conversiei electrice sau chimice.
Tabelul 18. Tratamentul
farmacologic inaintea conversiei electrice a FA persistente:
eficienta diverselor antiaritmice pe rezultatele imediate ale socului electric
extern
|
Eficienta |
Faciliteaza conversia si previn RIFAa |
Suprima RSFA si tratament de intretinere |
Clasa de recomandare |
Nivel de evidenta |
|
Cunoscuta |
Amiodarona Flecainida Ibutilid Propafenona Chinidina Sotalol |
Toate medicamentele au clasa de indicatie I (cu exceptia ibutilidului) plus betablocantele |
I |
B |
|
Necunoscuta |
Betablocante Diltiazem Disopiramida Dofetilid Procainamida Verapamil |
Diltiazem Dofetilid Verapamil |
IIb |
C |
aMedicamentele sun ordonate alfabetic in cadrul fiecarei clase de recomandare
Toate medicamentele (cu exceptia betablocantelor) trebuie initiate in spital
FA, fibrilatie atriala; RIFA, recurenta imediata a fibrilatiei atriale; RSFA recurenta subacuta a fibrilatiei atriale.
Pentru prevenirea emboliilor tardive este necesara anticoagularea pentru o perioada mai lunga dupa conversie si durata anticoagularii depinde de probabilitatea recurentei FA simptomatice sau nu dar si de riscul embolic al fiecarui pacient. Emboliile sunt probabil datorate dezvoltarii trombului in perioada de disfunctie mecanica tranzitorie si recuperarii tardive a contractiei atriale dupa conversie. Pacientii cu flutter atrial la care se efectueaza conversie necesita aceleasi strategii de anticoagulare sau control TEE deoarece accidentele vasculare cerebrele si emboliile sisemice au fost descrise si in aceste situatii. 295-297 Conversia TEE ghidata a flutterului atrial e insotita de un risc mic de embolii sistemice, mai ales atunci cand se face o stratificare a factorilor de risc pe baza elementelor clinice/TEE.
Paroxistica sau persistenta, fibrilatia atriala este o afectiune cronica, si la majoritatea pacientilor apar recurente.299-301 Mare parte din pacienti necesita terapie antiaritmica profilactica pentru mentinerea ritmului sinusal, supresia simptomelor, amelioararea capacitatii de efort si a functiei hemodinamice si prevenirea cardiomiopatiei indusa de FA cu frecventa rapida. Deoarece factorii care predispun la recurenta FA (varsta inaintata, IC, hipertensiunea, dilatarea AS, disfunctia VS) sunt in acelasi timp factori de risc embolic, riscul de accident vascular cerebral ar putea sa nu fie redus doar de corectia tulburarii de ritm. Studiile care au urmarit ativ strategiile de control al ritmului sau al frecventei la pacientii cu FA persistenta si paroxistica 124,126,127,130,132 nu au demonstrat reducerea mortalitatii, accidentelor vasculare cerebrale, spitalizarilor, aritmiilor nou aparute sau complicatiilor embolice in grupul de control al ritmului.
La cei mai multi dintre pacientii cu FA, cu exceptia celor cu FA postoperatorie sau limitata pe durata unor afectiuni acute sau tranzitorii, apar recurente. Factorii de risc pentru recurentele frecvente ale FA paroxistice (mai mult de un episod pe luna) sunt genul feminin si afectarea cardiaca structurala.302 Un studiu a demonstrat ca la pacientii cu FA persistenta care au fost convertiti la ritm sinusal cu un singur soc electric extern, fara profilaxie antiaritmica, la patru ani, mai putin de 10% din pacienti nu aveau recurente.300 Predictorii recurentelor, in acest interval, au fost varsta peste 55 de ani, hipertensiunea si durata FA peste trei luni. Conversii repetate asociate cu profilaxia antiaritmica au mentinut aproximativ 30% din pacienti300 fara recurente, iar cu aceasta strategie factorii predictori ai recurentelor au fost varsta peste 70 de ani, durata FA peste trei luni si IC.300 Alti factori de risc pentru FA recurenta au fost dilatarea AS si bolile cardiace reumatismale.
Dupa conversie pot aparea arimii benigne - extrasistole ventriculare si supraventriculare, bradicardie si perioade scurte de oprire sinusala, insa, de obicei, acestea sunt autolimitate.266 Aritmii severe - tahicardie si fibrilatie ventriculara pot aparea la pacientii cu hipopotasemie, intoxicatie digitalica sau in cazul folosirii socului nesincron.267,268 Pentru siguranta si eficienta conversiei valorile potasemiei trebuie sa fie in limite normale. Conversia este contraindicata in cazul intoxicatiei digitalice deoarece pot aparea aritmii ventriculare greu de controlat.
La pacientii cu FA de durata mai lunga conversia poate demasca boala de nod sinusal. Frecventa ventriculara lenta a FA in absenta medicamentelor dromotrop negative poate indica o tulburare intrinseca de conducere. In aceasta situatie este utila folosirea profilactica a stimularii transvenoase sau transcutane.269
Inaintea administrarii oricarui antiaritmic, cauzele reversibile care ar putea precipita FA trebuie identificate si corectate. Cele mai multe sunt datorate bolilor coronariene sau valvulare, hipertensiunii si IC. Pacientii cu FA aparuta dupa ingestia de alcool ar trebui sa renunte la consumul de alcool. Rareori este prescris tratament antiaritmic permanent dupa un prim episod de FA, insa o perioada de cateva saptamani de tratament antiaritmic ar putea contribui la stabilizarea ritmului sinusal dupa conversie. Pacientii care repeta FA sub tratamentul antiaritmic nu necesita schimbarea medicatiei daca recurentele sunt rare si bine tolerate. Betablocantele sunt utile la pacientii cu FA aparuta la efort, dar rareori un singur mecanism declanseaza toate episoadele de FA, astfel incat, pentru mentinerea ritmului sinusal, este nevoie de antiaritmice. Alegerea antiaritmicului se face in functie de boala cardiaca de fond, dar si de frecventa si caracteristicile clinice ale episoadelor.303
La pacientii cu FA fara boala cardiaca de fond se poate incepe cu un betablocant, dar flecainida, propafenona si sotalolul sunt mai eficiente. Amiodarona si dofetilidul sunt recomandate ca alternative. Chinidina, procainamida si disopiramida nu sunt administarate decat in situatiile in care amiodarona este ineficienta sau contraindicata. La pacientii cu FA vagala efectele anticolinergice ale disopiramidei par a fi benefice. In aceasta situatie, flecainida si amiodarona sunt a doua, respectiv a treia optiune, iar propafenona nu este recomandata pentru ca activitatea sa betablocanta intrinseca (slaba) ar putea agrava FA mediata vagal.
La pacientii cu FA mediata adrenergic, betablocantele sunt prima linie de tratament, urmate de sotalol si amiodarona. Amiodarona este mai putin atractiva insa in cazul FA adrenergic mediate la pacientii fara afectare cardiaca. FA vagal indusa poate aparea ca manifestare izolata, dar de cele mai multe ori se incadreaza intr-un profil al pacientului. In cazul FA nocturne este posibila asocierea cu apneea aparuta in timpul somnului.
Atunci cand un antiaritmic nu da rezultate pot fi incercate combinatii. Combinatii utile sunt intre un betablocant, sotalol sau amiodarona cu un antiaritmic de clasa IC. O alta combinatie este intre un blocant de calciu, de exemplu diltiazem si un antiaritmic de clasa IC (flecainida sau propafenona).
Un antiaritmic considerat initial sigur poate deveni proaritmic in conditiile interactiunii cu alte medicamente sau daca pacientul dezvolta boala coronariana sau IC. Pacientii ar trebui avertizati in legatura cu aparitia unor simptome ca sincopa, angina, dispneea precum si despre utilizarea medicamentelor care prelungesc intervalul QT.
Metodele de monitorizare a efectelor antiaritmicelor variza in functie de medicamentul folosit si de caracteristicile fiecarui pacient. La acest moment nu exista date prospective despre durata maxima a complexului QRS sau a intervalului QT induse de medicamente. Atunci cand sunt utilizate antiaritmice din clasa IC durata QRS nu trebuie sa depaseasca 50% fata de valoarea initiala. Testarea la efort poate detecta alungirea QRS care apare doar la frecvente rapide (incetinire a conducerii prin mecanism use-dependent). Pentru antiaritmicele de clasa IA si III (posibil cu exceptia amiodaronei) intervalul QT corectat in ritm sinusal trebuie mentinut sub 520 ms. Valorile plasmatice ale potasiului si magneziului trebuie urmarite periodic, la fel si functia renala, deoarece insuficienta renala duce la acumularea antiaritmicelor si predispune la proaritmii. Atunci cand apar manifestari clinice de IC in timpul tratamentului FA este necesara evaluarea neinvaziva a functiei ventriculare.
Algoritmul de tratament antiaritmic pentru mentinerea ritmului sinusal la pacientii cu FA( urile 7-l0) si afectare cardiaca este bazat pe dole existente si pe experienta utilizarii acestor medicamente in alte situatii.
Insuficienta cardiaca. Pacientii cu IC sunt predispusi la efectele proaritmice ale antiaritmicelor datorita vulnerabilitatii miocardului si dezechilibrelor electrolitice. Trialurile randomizate au demonstrat siguranta administrarii amiodaronei si dofetilidului (administrate separat) la pacientii cu FA si IC.200,304 In cazul disfunctiei de VS si a FA persistente este necesar tratamentul cu betablocante, inhibitori ai ECA si/sau antagonisti de receptori ai angiotensinei care ajuta la controlul frecventei, amelioreaza functia ventriculara si prelungesc supravietuirea.305-308
Boala cardiaca ischemica. La pacientii cu BCI stabila prima alegere sunt betablocantele, desi utilizarea lor este sustinuta doar de 2 studii,309,310 iar in ceea ce priveste mentinerea ritmului sinusal dupa conversie rezultatele nu sunt convingatoare.310 Sotalolul are activitate betablocanta substantiala si ar putea fi primul antiaritmic de ales la pacientii cu FA si boala cardiaca ischemica deoarece toxicitatea pe termen lung este mai redusa decat in cazul amiodaronei. Amiodarona creste riscul aparitiei bradiaritmiilor care necesita cardiostimulare permanenta la pacientii varstnici cu FA si infarct in antecedente,311 dar este preferata sotalolului la pacientii cu IC.312,313 Flecainida si propafenona nu sunt recomandate in aceste situatii, dar chinidina, procainamida si disopiramida ar putea fi a treia linie de tratament la pacientii cu BCI. La pacientii cu antecedente de IM dofetilidul este a doua linie de tratament - studiul DIAMOND-MI (Danish Investigations of Arrhythmias and Mortality on Dofetilide in Myocardial Infarction)314 a inclus pacienti postinfarct la care beneficiul antiaritmic a depasit riscul proaritmiei. In cazul BCI fara IM sau IC nu este sigur daca beneficiul administrarii dofetilidului depaseste riscurile si sunt necesare do suplimentare pentru a fi recomandat acestor pacienti (ura 9).
Hipertensiunea arteriala. Hipertensiunea este factor de risc independent (cu cea mai mare prevalenta si potential modificabil) pentru aparitia FA si a complicatiilor acesteia, mai ales a trombembolismului.315,316 Controlul tensiunii arteriale ar putea deveni o strategie pentru prevenirea aparitiei FA. La pacientii cu hipertrofie ventriculara stanga exista un risc crescut de aparitie a torsadei varfurilor datorata postdepolarizarilor precoce.303,317 Astfel, antiaritmicele de clasa IC si amiodarona sunt preferate claselor IA si III ca prima linie de tratament. In absenta ischemiei si a hipertrofiei ventriculare stangi pot fi alese atat propafenona cat si flecainida. Aparitia proaritmiei la un medicament nu prezice acelasi raspuns la un altul, asfel incat pacientii care dezvolta torsada varfurilor la un antiaritmic de clasa III ar putea tolera altul din clasa IC. Amiodarona prelungeste intervalul QT, insa riscul de proaritmie este scazut. Atunci cand amiodarona si sotalolul sunt ineficiente sau nu sunt indicate, disopiramida, chinidina sau procainamida sunt alternative.
Betablocantele sunt prima linie de tratament pentru mentinerea ritmului sinusal la pacientii cu IM, IC si hipertensiune arteriala. Sansa de mentinere a ritmului sinusal dupa conversie cu betablocante este mai mare la cei cu hipertensiune arteriala decat la cei fara boala cardiaca.318 Medicamentele care moduleaza SRAA reduc modificarile cardiace structurale,319 iar inhibarea ECA a fost asociata cu o incidenta mai scazuta a FA ativ cu blocarea canalelor de calciu la pacientii cu hipertensiune intr-un studiu retrospectiv longitudinal de cohorta dintr-o baza de date de 8 milioane de pacienti pe o durata de 4,5 ani.320 La pacientii cu risc crescut de evenimente cardiovasculare, administrarea de Ramipril 321-323 (inhibitor al ECA) sau losartan324,325 (antagonist al receptorilor angiotensinei) a scazut riscul de accident vascular cerebral. Rezultate similare a avut administarea de perindopril la pacientii tratati pentru prevenirea accidentului vascular cerebral.326 Aparitia FA si a accidentului vascular cerebral au fost reduse semnificativ de tratamentul cu losartan ativ cu atenolol la pacientii hipertensivi cu hipetrofie ventriculara stanga documentata ECG, desi reducerea valorilor TA a fost similara.16 Beneficiul administrarii losartanului a fost mai mare la pacientii cu FA decat la cei cu ritm sinusal pentru endpoint-ul compozit (mortalitate cardiovasculara, accident vascular cerebral, IM) si pentru mortalitatea cardiovasculara separat.327 Efectele betablocantelor si ale modulatorilor SRAA sunt in parte datorate scaderii valorilor tensiunii arteriale.
Efectele inconstante si toxicitatea antiaritmicelor au dus la explorarea unui spectru larg de terapii alternative nefarmacologice pentru prevenirea si controlul FA.
Dupa un deceniu de cercetari in anii '80 s-a demonstrat ca elementele critice pentru tratarea FA chirurgical ar fi eliminarea tuturor circuitele de macroreintrare din atriu cu prezervarea nodului sinusal si a functiei atriale de transport. Tehnica chirurgicala a avut la baza ipoteza ca reintrarea este mecanismul principal de initiere si mentinere a FA, iar inciziile atriale in anumite zone critice ar crea bariere in calea conducerii si ar preveni FA sustinuta. Procedura s-a bazat pe conceptul unui labirint (maze) geografic, iar aceasta denumire (maze) a fost aleasa pentru a descrie procedura chirugicala.329 De la momentul introducerii, procedura a trecut prin trei etape (maze I, II si III) utilizand tehnici de incizie si sutura care izoleaza VP, conecteza aceste linii cu inelul mitral si creeaza bariere electrice in AD care impiedica ritmurile macroreintrante flutterul sau fibrilatia atriala sa devina sustinute.330 Rate de succes de aproximativ 95% de-a lungul a 15 ani de urmarire au fost raportate la pacientii cu interventii chirurgicale ale valvei mitrale.331 Conform altor studii rata de succes este de 70%.332 Functia atriala de transport este mentinuta, iar combinarea cu amputarea si obliterarea US scade substantial riscul evenimentelor embolice. Riscurile procedurii sunt decesul (mai putin de 1% in cazul unei proceduri izolate), necesitatea stimularii permanente (datorita leziunilor AD), hemoragii persistente care necesita reinterventia, alterarea functiei atriale de transport, aritmii tardive (mai ales flutter atrial) si fistule atrioesofagiene. Desi succesul procedurii este mare, operatia maze nu a fost adoptata pe scara larga decat la pacientii cu o alta indicatie de chirurgie cardica deoarece necesita bypass cardiopulmonar. In prezent sunt investigate proceduri mai putin invazive - tehnici toracoscopice sau cu cateter epicardic. 332 Daca eficienta lor se apropie de cea a procedurii maze si riscurile sunt mai mici, acestea ar putea deveni alternative acceptabile pentru multi pacienti cu FA.
Primele tehnici de ablatie cu radiofrecventa au constat in generarea unor cicatrice liniare la nivelul endocardului atrial, rivalizand asfel cu procedura chirurgicala maze.333 Rata de succes a fost de 40-50%, insa complicatiile frecvente au diminuat entuziasmul initial.38 Observatiile conform carora potentiale din zona ostiilor VP provoaca adesea FA si demonstrarea ca ablatia acestor focare intrerupe FA au crescut speranta in folosirea acestei tehnici.38 Initial au fost tintite zonele de automatism din VP si pe o serie de 45 de pacienti cu FA paroxistica, 62% nu au repetat FA simptomatica pe o perioada de urmarire de 8 luni, insa 70 % au necesitat mai multe proceduri. 38 Intr-un alt studiu rata de succes a fost de 86% pe o perioada de urmarire de 6 luni.334 Studiile ulterioare au demonstrat ca potentialele pot aparea in diverse zone din AS si AD, inclusiv peretele posterior al AS, vena cava superioara, vena lui Marshall, crista terminalis, septul interatrial si sinusul coronar 335 , iar procedura modificata a inclus ablatii liniare in AS, la nivelul istmului mitral sau ambele pentru anumiti pacienti.336
Tehnica de ablatie a evoluat de la primele incercari care vizau focare individuale din zona VP pana la izolarea electrica circumferentiala a intregii musculaturi a VP. Pe o serie de 70 de pacienti, 73% nu au repetat FA dupa izolarea VP fara medicatie antiaritmica pe o perioada de urmarire de 4 luni, dar 29 de pacienti au necesitat o a doua procedura. Postablatie, FA poate aparea tranzitor in primele doua luni.337
Tehnicile de izolare a venelor pulmonare la nivelul antrului, folosind un cateter cu traseu circular ghidat de ecografie intracardiaca, au raportat la 80% din pacientii cu FA paroxistica absenta recurentelor FA sau flutterului atrial dupa primele doua luni338, insa rata de succes a fost mai mica la pacientii cu disfunctie ventriculara.339 O alta tehnica340,341 foloseste un sistem de ghidaj nefluoroscopic, iar curentul de radiofrecventa este eliberat circumferential in afara ostiilor VP. Pe o serie de 26 de pacienti, 85% nu au repetat FA pe o perioada de urmarire de 9 luni, inclusiv cei 62% care nu au luat medicatie antiaritmica. Experienta acumulata include aproape 4000 de pacienti 341 cu rata de succes de aproximativ 90% in cazurile de FA paroxistica si 80% in cazul FA persistente.339,342,343
O alta abordare anatomica a ablatiei cu radiofrecventa presupune utlizarea de electrograme fractionate complexe344 cu succes de 91% raportat la un an. Restabilirea ritmului sinusal dupa ablatia FA a ameliorat semnificativ functia VS, capacitatea de efort, simptomele si calitatea vietii (de obicei dupa primele 3-6 luni), chiar in prezenta unei boli cardiace de fond sau a unei frecvente ventriculare a FA bine controlata inaintea ablatiei.345 Desi acest studiu nu a avut un grup control de pacienti cu IC, intr-un alt studiu ablatia cu cateter a FA s-a asociat cu reducerea mortalitatii si morbiditatii datorate IC si trombembolismului.346 La anumiti pacienti, ablatia cu radiofrecventa a nodului AV si imtarea unui stimulator au diminuat simptomele FA si au ameliorat calitatea vietii ativ cu terapia medicamentoasa.140-l42,347-349 O metaanaliza a 10 studii la pacienti cu FA143 a constatat ameliorarea simptomelor si a scorurilor de calitate a vietii dupa ablatie urmata de stimulare. Desi aceste studii au inclus pacienti selectati care au ramas in FA, ameliorarea semnificativa sugereaza ca inaintea ablatiei calitatea vietii era afectata. In ciuda tehnicilor avansate, eficienta pe termen lung a ablatiei cu cateter pentru prevenirea recurentelor FA necesita studii suplimentare. Datele existente demonstreaza absenta recurentelor timp de un an sau chiar mai mult la majoritatea pacientilor (selectati totusi destul de atent).350-352 Este important de reamintit ca nu intotdeauna episoadele de FA sunt simptomatice si pot trece neobservate de catre pacient sau de catre medic. De aceea nu este sigur daca aparenta vindecare nu reprezinta de fapt transformarea intr-o FA paroxistica asimptomatica. Diferentierea este importanta pentru stabilirea duratei tratamentului anticoagulant la pacientii cu factori de risc pentru accidentul vascular cerebral asociat cu FA. In plus datele despre succesul pe termen lung al ablatiei sunt limitate la pacientii cu IC sau alte boli cardiace structurale avansate, la care absenta recurentelor este mai putin probabila. Complicatiile ablatiei cu cateter sunt similare oricarei proceduri de cateterism cardiac, la care se adauga cele specifice ablatiei FA. Complicatii majore au fost raportate la aproximativ 6% din pacienti si au inclus stenoza VP, trombembolismul, fistula atrioesofagiana si flutterul.343 Tehnicile initiale care tinteau ectopiile de la nivelul VP au fost asociate cu o rata inacceptabil de mare de stenoza a VP 334,353, dar aceste complicatii au diminuat semnificativ dupa schimbarea procedurii. Tehnicile curente evita eliberarea energiei de radiofrecventa la nivelul VP si tintesc zonele din afara venelor pentru a izola ostiile de restul tesutului de conducere din AS. Utilizarea ecografiei intracardiace pentru a detecta formarea de microbule cu ajutorul carora se titreaza energia eliberata contribuie la reducerea incidentei stenozelor VP.338
Accidentul cerebral embolic este cea mai temuta complicatie a ablatiei cu cateter la pacientii cu FA. Incidenta variaza intre 0% si 5%. Intensitatea mai mare a anticoagularii reduce riscul de formare a trombului in timpul ablatiei.354 Pe baza datelor limitate din studii cu doze ate, se pare ca anticoagularea agresiva reduce incidenta trombembolismului asociat ablatiei cu cateter a FA.
Fistula atrioesofagiana a fost raportata atat cu abordarea circumferentiala a lui Pappone 355,356 cat si cu tehnica de ablatie Haissaguerre a VP 356, dar este destul de rara. Aceasta complicatie este mai probabila atunci cand se fac leziuni de ablatie extensive la nivelul peretelui posterior al AS, crescand riscul perforatiei atriale. Manifestarile tipice sunt simptome neurologice brusc instalate sau endocardita, iar evolutia este de cele mai multe ori cu deces. In functie de procedura folosita, in timpul ablatiei poate aparea flutter atrial,357 care se rezolva printr-o noua ablatie. 358
Ablatia cu cateter este o realizare semnificativa care promite un tratament eficient al pacientilor rezistenti la terapia medicamentoasa sau la tentativele de conversia electrica a FA. Studiile acuale, in numar redus, sugereaza ca ablatia cu cateter ofera beneficii anumitor pacienti cu FA, dar aceste studii nu ofera do convingatoare pentru pozitia optima a cateterului sau despre rata de succes absolut. Selectarea pacientilor care ar putea beneficia de ablatie trebuie sa ia in calcul atat beneficiile potentiale cat si riscurile pe termen scurt si lung. Rata de succes si complicatiile variaza, uneori considerabil, de la un studiu la altul, iar aceste diferente sunt legate de factori care tin de pacient, tipul FA, criteriile pentru definirea succesului, durata urmaririi si aspectele tehnice. Registrele cu serii de cazuri ar trebui sa contina variabile clare si prospective pentru aprecierea rezultatelor. Studiile dublu orb sunt aproape imposibil de relizat, si totusi, este nevoie de studii randomizate in care evaluarea rezultatelor sa fie orbita referitor la metoda de tratament. O evaluare clara a efectelor favorabile si adverse ale diverselor tehnici de ablatie ar trebui sa includa aprecierea calitatii vietii si a ratei recurentelor ativ cu metodele de tratament farmacologic pentru controlul ritmului, sau, daca acestea nu sunt eficiente, cu tehnicile de control al frecventei cum ar fi ablatia nodului sinusal urmata de stimulare. Aceste date ative pe perioade relativ lungi de urmarire s-ar adresa metodelor de tratament invaziv si conservator existente pentru FA si ar oferi baza viitoarelor ghiduri de practica.
Mai multe studii au urmarit rolul pacing-ului atrial la nivelul AD sau in mai multe locatii atriale pentru prevenirea recurentelor FA paroxistice. La pacientii cu bradicardie simptomatica, riscul de FA este mai mic cu pacing atrial decat cu pacing ventricular.359 In cazul bolii de nod sinusal cu conducere AV normala datele din mai multe studii randomizate sustin folosirea pacing-ului atrial sau bicameral in detrimentul celui ventricular pentru prevenirea FA.360-363 Mecanismele prin care pacing-ul atrial previne FA la pacientii cu disfunctie de nod sinusal sunt impiedicarea dispersiei repolarizarii induse de bradicardie si suprimarea extrasistolelor atriale. Pacing-ul atrial sau biventricular mentine sincronismul AV, prevenind conducerea retrograda ventriculoatriala, care poate duce la regurgitari valvulare si la modificari induse de intindere ale electrofiziologiei atriale. Atunci cand pacingul ventricular cu sonde bicamerale este necesar datorita afectarii conducerii AV, dole superioritatii pacing-ului atrial sunt mai putin clare. Desi stimularea atriala este asociata cu un risc mai mic de FA si accident vascular cerebral decat stimularea ventriculara la pacientii cu bradiaritmii care necesita stimulatoare, valoarea cardiostimularii ca terapie primara pentru FA recurenta nu a fost dovedita.
In ultimii 10 ani interesul pentru conversia interna a FA a crescut.135 Cercetarile clinice pentru gasirea unor unde de soc tolerablie au dus la aparitia unui dispozitiv imtabil capabil de sensing atrial si cardioversie si de sensing si pacing ventricular. Acest dispozitv a fost evaluat la 290 de pacienti cu fractie de ejectie a VS mai mare de 50% care nu au raspuns satisfacator la tratamentul cu 4 antiaritmice.135 Rata de conversie la ritm sinusal a fost de 93%. Episoadele spontane au fost tratate rapid, iar intervalul dintre episoade a crescut. Exista mai multe dispozitive care combina conversia atriala si defibrilarea ventriculara cu sensingul si pacing-ul bicamerale si acestea au fost utilizate pentru tratamentul aritmiilor atriale si ventriculare prin pacing inaintea descarcarii socurilor cu energie joasa sau inalta.
Una dintre limitele importante ale defibrilatoarelor atriale, nelegata de eficienta, este aceea ca majoritatea pacientilor considera energiile de 1J deranjante. Candidatii pentru defibrilatoarele atriale, cu episoade rare de FA, prost tolerate, sunt in acelasi timp pacientii tipici pentru ablatia cu cateter. Prin urmare, defibrilatoarele atriale au utilizare limitata, cu exceptia pacientilor cu disfunctie de VS care sunt candidati pentru defibrilatoare imtabile.
Desi metodele de preventie primara a FA nu au fost investigate pe larg, sunt date ca pacing-ul atrial sau AV sincron ar reduce incidenta FA la pacientii cu bradicardie ativ cu pacing-ul ventricular. 359,360 Pe de alta parte, studiile la pacientii cu tahiaritmii atriale intermitente nu au demonstrat beneficiile pacing-ului atrial. 360,365,366 O alta cale posibila de preventie primara a fost sugerata dupa analiza secundara a studiilor placebo controlate cu inhibitori de ECA.56,367 In studiile LIFE (Losartan Intervention For End Point Reduction in Hypertension)16 si CHARM (Candesartan in Heart Filure Assessment of Reduction in Mortality and Morbidity)368, antagonisii receptorilor angiotensinei, losartan si candesartan, au redus incidenta FA la pacientii hipertensivi cu hipertrofie ventriculara stanga16 si IC simptomatica.21,368 Aceste rezultate, impreuna cu profilul lor sigur ativ cu medicatia antiaritmica, sugereaza rolul favorabil al inhibitorilor ECA sau al receptorilor angiotensinei pentru preventia primara sau a recurentelor FA asociata cu hipertensiunea, IM, IC sau diabetul zaharat. O analiza a 11 studii care au inclus peste 56.000 de pacienti cu diverse patologii cardiace a sugerat ca inhibitorii ECA si antagonisii receptorilor angiotensinei reduc aparitia si recurentele FA.55
Alte ipoteze insuficient explorate au sugerat ca utilizarea statinelor369,370 si componentele lipidice din alimentatie ar influenta tendinta pacientilor de a dezvolta FA.371 Pe un studiu cu 449 de pacienti cu BCI urmariti timp de 5 ani, tratamentul cu statine a redus incidenta FA - efect care nu a fost observat la alte medicamente hipolipemiante.369 In acest moment nu sunt suficiente date pentru a recomanda in scopul preventiei primare a FA, la populatia cu risc, modificari ale dietei, tratamente farmacologice, pacing sau alte dispozitive.
Managementul pacientilor cu FA presupune cunoasterea tipului sau de prezentare (paroxistica, persistenta sau permanenta), a conditiilor asociate sau preexistente precum si luarea de decizii privind restaurarea si mentinerea ritmului sinusal, controlul frecventei ventriculare si terapia antitrombotica. Aceste aspecte sunt abordate in algoritmurile de management al fiecarui tip de FA ( urile 7-l0).
Nu este intotdeauna clar daca prezentarea initiala a FA este cu adevarat primul episod de aritmie, in special la pacientii cu simptome minime sau asimptomatici. La pacientii cu episoade autolimitate de FA, nu este de obicei nevoie de tratament antiaritmic pentru prevenirea recurentelor, cu exceptia situatiei in care FA este asociata cu simptome severe legate de hipotensiune, ischemie miocardica sau IC. In ceea ce priveste anticoagularea, rezultatele studiului AFFIRM132 arata faptul ca pacientii afalti la risc inalt pentru AVC pe baza factorilor de risc identificati, beneficiaza de pe urma anticoagularii chiar si dupa ce s-a produs conversia la ritm sinusal. Prin urmare, cu exceptia situatiei in care exista cu certitudine un factor precipitant reversibil pentru FA (cum ar fi hipertiroidia care a fost corectata), diagnosticul de FA la un pacient cu factori de risc pentru trombembolietrebuie sa determine anticoagulare pe termen lung.
Atunci cand FA persista, o optiune este aceea de a accepta progresia la FA permanenta,avand atentie la terapia antitrombotica si la controlul frecventei ventriculare. Desi ar putea parea rezonabil sa se faca macar o incercare de restabilire a ritmului sinusal, studiul AFFIRM a aratat faptul ca nu exista nici o diferenta in ceea ce priveste supravietuirea sau calitatea vietii, intre strategia de control al frecventei si cea de control al ritmului.132 Alte studii pe aceeati tema au ajuns la concluzii similare.124,126,127,130 Prin urmare, decizia de a incerca restabilirea ritmului sinusal trebuie sa fie bazata pe severitatea simptomelor legate de aritmie si potentialele riscuri ale medicamentelor antiaritmice. Daca se decide incercarea restabilirii si mentinerii ritmului sinusal, atunci inaintea cardioversiei sunt importante anticoagularea si controlul frecventei. Desi s-ar putea sa nu fie nevoie de tratament antiaritmic pe termen lung in scopul prevenirii recurensei FA dupa cardioversie, aceasta terapie poate fi benefica pe termen scurt. La pacientii la care FA dureaza de mai mult de 3 luni, recurenta precoce dupa cardioversie este frecventa. In asemenea cazuri, pentru a reduce riscul recurentei, se poate initia tratament antiaritmic inaintea cardioversiei (dupa anticoagulare corespunzatoare), durata acestuia fiind scurta (de ex. 1 luna).
La pacientii care au episoade recurente de FA paroxistica scurte sau minim simptomatice, este de dorit sa se evite medicamentele antiaritmice, in timp ce prezenta simptomelor suparatoare determina de obicei administrarea acestui tip de medicatie. Controlul frecventei si preventia trombemboliei sunt indicate in ambele situatii. La un pacient oarecare pot fi eficiente mai multe medicamente antiaritmice, astfel incat alegerea initiala se bazeaza in principal pe siguranta si tolarabilitate (ura 9). Pentru indivizii cu afectare cardiaca minima sau inexistenta se recomanda ca terapie antiaritmica initiala flecainida, propafenona sau sotalolul pentru ca sunt in general bine tolerate si cu relativ putine riscuri. Pentru pacientii cu episoade recurente de FA asimptomatica, administrarea medicatiei la nevoie reduce riscul de toxicitate ativ cu terapia sustinuta. Atunci cand aceste medicamente se dovedesc ineficiente sau determina reactii adverse, medicamentele de linia a doua sau a treia sunt amiodarona, dofetilid, disopiramida, procainamida sau chinidina, toate avand un risc mai mare de reactii adverse. Ca o alternativa la tratamentul cu amiodarona sau dofetilid atunci cand medicamentele de linia intai sunt ineficiente sau nu sunt tolerate, se pot lua in discutie modificarea substratului AS sau izolarea VP. Atunci cand contextul de aparitie sugereaza FA mediata vagal, medicamentele de prima alegere sunt disopiramida sau flecainida, iar la pacientii cu FA indusa adrenergic se recomanda beta-blocantele sau sotalolul. La pacientii foarte simptomatici la care tratamentul singur nu reuseste sa controleze aritmia, se pot lua in discutie optiuni non-farmacologice cum ar fi ablatia AS.
Multi pacienti cu boala cardiaca organica pot fi inclusi ca avand IC, BCI sau HTA. Insa, cum exista si alte tipuri de boli cardiace asociate cu FA, clinicianul trebuie sa determine boala care descrie cel mai bine pacientul. Pentru pacientii cu IC, datele de siguranta sustin alegerea amiodaronei sau dofetilidului pentru mentinerea ritmului sinusal. Pacientii cu BCI necesita adesea beta-blocante si sotalolul, un medicament care are atat actiune beta-blocanta cat si eficacitate antiaritmica intrinseca, trebuie sa fie prima alegere, cu exceptia situatiei in care pacientul are IC. Amiodarona si dofetilidul sunt considerati agenti de linia a doua, iar alegerea disopiramidei, chinidinei sau procainamidei, trebuie facuta de clinician pe baze individuale.
Alegerea medicamentului antiaritmic pentru pacienti cu istoric de HTA este ingreunata de numarul restrans de studii controlate care a siguranta si eficacitatea terapiei medicamentoase a FA. La pacientii hipertensivi fara HVS, se recomanda ca agenti de prima linie, flecainida si propafenona, medicamente ce nu alungesc repolarizarea sau intervalul QT, oferind astfel un plus de siguranta. Daca aceste medicamente sunt ineficiente sau determina efecte adverse, atunci urmatoarea alegere adecvata este reprezentata de amiodarona, dofetilid sau sotalol. Disopiramida, procainamida si chinidina sunt considerti agenti de a treia alegere in aceasta situatie. Miocardul hipertrofic este predispus la toxicitate proaritmica si la aparitia torsadei varfurilor. La pacienti cu HVS tratamentul de prima line este reprezentat de amiodarona datorita relativei sale sigurante ativ cu alte medicmente. Deoarece nici ECG, nici ecocardiografia nu deceleaza HVS definita de masurarea masei miocardului, clinicianul se poate afla in fata unei dileme.
Saracia datelor provenind din studii clinice randomizate referitoare la tratamentul pacientilor cu FA se refera la toate grupurile de pacienti. Prin urmare, algoritmurile de selectie a medicatiei prezentati aici sunt rezultatul consensului si vor fi revizuiti pe masura ce apar date noi.
Pacientii cu FA asmptomatica sau cu simptome minime carora li s-a efectuat cel putin o incercare de restabilire a ritmului sinusal, pot ramane in FA dupa recurenta, cu terapie de control al frecventei si de preventie a trombemboliei. Invers, cei cu simptome importante, care fac utila restabilirea ritmului sinusal, trebuie tratati inaintea cardioversiei cu un agent antiaritmic (pe langa terapia anticoagulanta si cea de control al frecventei). Alegerea antiaritmicului se bazeaza pe acelasi algoritm folosit pentru pacientii cu FA paroxistica recurenta. Daca pacientul ramane simptomatic in ciuda controlarii frecventei cardiace si medicatia antiaritmica este ineficienta sau nu este tolerata, se pot lua in discutie terapii non-farmacologice. Acestea includ ablatia AS sau ablatia nodului AV cu stimulare prin pacing.
Denumirea de FA permanenta se refera la acele cazuri la care ritmul sinusal nu poate fi sustinut dupa cardioversie sau la care medicul si pacientul au decis sa lase FA sa continue fara a mai face eforturi de a restabili ritmul sinusal. Pentru toti pacientii din aceasta categorie este important sa se mentina controlul frecventei ventriculare si sa se foloseasca terapia antitrombotica, asa dupa cum s-a subliniat in alta parte in acest document.
1. Bellet S. Clinical Disorders of the Heart Beat. 3rd ed. Philadelphia: Lea & Febiger, 1971.
2. Prystowsky EN, Katz AM. Atrial Fibrillation. In: Textbook of Cardiovascular Medicine. Philadelphia: Lippincott-Raven, 1998:1661.
3. Knight BP, Michaud GF, Strickberger SA, et al. Electrocardiographic differentiation of atrial flutter from atrial fibrillation by physicians. J Electrocardiol 1999;32:3159.
4. Allessie MA, Konings KT, Kirchhof CJ. Mapping of atrial fibrillation. In: Olsson SB, Allessie MA, Campbell RW, editors. Atrial Fibrillation: Mechanisms and Therapeutic Strategies. Armonk, NY: Futura, 1994:3749.
5. Kopecky SL, Gersh BJ, McGoon MD, et al. The natural history of lone atrial fibrillation. A population-based study over three decades. N Engl J Med 1987;317:66974.
6. Deleted in proof.
7. Friberg J, Buch P, Scharling H, et al. Rising rates of hospital admissions for atrial fibrillation. Epidemiology 2003;14:66672.
8. Le Heuzey JY, Paziaud O, Piot O, et al. Cost of care distribution in atrial fibrillation patients: the COCAF study. Am Heart J 2004;147:1216.
9. Go AS, Hylek EM, Phillips KA, et al. Prevalence of diagnosed atrial fibrillation in adults: national implications for rhythm management and stroke prevention: the AnTicoagulation and Risk Factors in Atrial Fibrillation (ATRIA) Study. JAMA 2001;285:23705.
10. Furberg CD, Psaty BM, Manolio TA, et al. Prevalence of atrial fibrillation in elderly subjects (the Cardiovascular Health Study). Am J Cardiol 1994;74:23641.
11. Friberg J, Scharling H, Gadsboll N, et al. Sex-specific increase in the prevalence of atrial fibrillation (The Copenhagen City Heart Study). Am J Cardiol 2003;92:141923.
12. Levy S, Maarek M, Coumel P, et al. Characterization of different subsets of atrial fibrillation in general practice in France: the ALFA study. The College of French Cardiologists. Circulation 1999;99:302835.
13. Psaty BM, Manolio TA, Kuller LH, et al. Incidence of and risk factors for atrial fibrillation in older adults. Circulation 1997;96:245561.
14. Crijns HJ, Tjeerdsma G, De Kam PJ, et al. Prognostic value of the presence and development of atrial fibrillation in patients with advanced chronic heart failure. Eur Heart J 2000;21:123845.
15. Madrid AH, Bueno MG, Rebollo JM, et al. Use of irbesartan to maintain sinus rhythm in patients with long-lasting persistent atrial fibrillation: a prospective and randomized study. Circulation 2002;106:3316.
16. Wachtell K, Lehto M, Gerdts E, et al. Angiotensin II receptor blockade reduces new-onset atrial fibrillation and subsequent stroke ed to atenolol: the Losartan Intervention For End Point Reduction in Hypertension (LIFE) study. J Am Coll Cardiol 2005;45:7129.
17. Atrial Fibrillation Investigators. Risk factors for stroke and efficacy of antithrombotic therapy in atrial fibrillation. Analysis of pooled data from five randomized controlled trials [published erratum appears in Arch Intern Med 1994;154:2254]. Arch Intern Med 1994;154:144957.
18. Stewart S, Hart CL, Hole DJ, et al. A population-based study of the long-term risks associated with atrial fibrillation: 20-year follow-up of the Renfrew/Paisley study. Am J Med 2002;113:35964.
19. Krahn AD, Manfreda J, Tate RB, et al. The natural history of atrial fibrillation: incidence, risk factors, and prognosis in the Manitoba Follow-Up Study. Am J Med 1995;98:47684.
20. Poole-Wilson PA, Swedberg K, Cleland JG, et al. Comparison of carvedilol and metoprolol on clinical outcomes in patients with chronic heart failure in the Carvedilol Or Metoprolol European Trial (COMET): randomised controlled trial. Lancet 2003;362:713.
21. Maggioni AP, Latini R, Carson PE, et al. Valsartan reduces the incidence of atrial fibrillation in patients with heart failure: results from the Valsartan Heart Failure Trial (Val-HeFT). Am Heart J 2005;149:54857.
22. Wang TJ, Larson MG, Levy D, et al. Temporal relations of atrial fibrillation and congestive heart failure and their joint influence on mortality: the Framingham Heart Study. Circulation 2003;107:29205.
23. Wolf PA, Abbott RD, Kannel WB. Atrial fibrillation as an independent risk factor for stroke: the Framingham Study. Stroke 1991;22:9838.
24. Hart RG, Halperin JL. Atrial fibrillation and thromboembolism: a decade of progress in stroke prevention. Ann Intern Med 1999;131:68895.
25. Wolf PA, Dawber TR, Thomas HE Jr, et al. Epidemiologic assessment of chronic atrial fibrillation and risk of stroke: the Framingham study. Neurology 1978;28:9737.
26. Bharti S, Lev M. Histology of the normal and diseased atrium. In: Fall RH, Podrid PJ, editors. Atrial Fibrillation: Mechanism and Management. New York: Raven Press, 1992:1539.
27. Allessie M, Ausma J, Schotten U. Electrical, contractile and structural remodeling during atrial fibrillation. Cardiovasc Res 2002;54:23046.
28. Aime-Sempe C, Folliguet T, Rucker-Martin C, et al. Myocardial cell death in fibrillating and dilated human right atria. J Am Coll Cardiol 1999;34:157786.
29. Polontchouk L, Haefliger JA, Ebelt B, et al. Effects of chronic atrial fibrillation on gap junction distribution in human and rat atria. J Am Coll Cardiol 2001;38:88391.
30. Mary-Rabine L, Albert A, Pham TD, et al. The relationship of human atrial cellular electrophysiology to clinical function and ultrastructure. Circ Res 1983;52:18899.
31. Bailey GW, Braniff BA, Hancock EW, et al. Relation of left atrial pathology to atrial fibrillation in mitral valvular disease. Ann Intern Med 1968;69:1320.
32. Pokharel S, van Geel PP, Sharma UC, et al. Increased myocardial collagen content in transgenic rats overexpressing cardiac angiotensinconverting enzyme is related to enhanced breakdown of N-acetyl-Ser-Asp-Lys-Pro and increased phosphorylation of Smad2/3. Circulation 2004;110:312935.
33. Goette A, Staack T, Rocken C, et al. Increased expression of extracellular signal-regulated kinase and angiotensin-converting enzyme in human atria during atrial fibrillation. J Am Coll Cardiol 2000;35:166977.
34. Kumagai K, Nakashima H, Urata H, et al. Effects of angiotensin II type 1 receptor antagonist on electrical and structural remodeling in atrial fibrillation. J Am Coll Cardiol 2003;41:2197204.
35. Verheule S, Wilson E, Everett T, et al. Alterations in atrial electrophysiology and tissue structure in a canine model of chronic atrial dilatation due to mitral regurgitation. Circulation 2003;107:261522.
36. Sanders P, Morton JB, Davidson NC, et al. Electrical remodeling of the atria in congestive heart failure: electrophysiological and electroanatomic mapping in humans. Circulation 2003;108:14618.
37. Jais P, Haissaguerre M, Shah DC, et al. A focal source of atrial fibrillation treated by discrete radiofrequency ablation. Circulation 1997;95:5726.
38. Haissaguerre M, Jais P, Shah DC, et al. Spontaneous initiation of atrial fibrillation by ectopic beats originating in the pulmonary veins. N Engl J Med 1998;339:65966.
39. Schwartzman D, Bazaz R, Nosbisch J. Common left pulmonary vein: a consistent source of arrhythmogenic atrial ectopy. J Cardiovasc Electrophysiol 2004;15:5606.
40. Hsu LF, Jais P, Keane D, et al. Atrial fibrillation originating from persistent left superior vena cava. Circulation 2004;109:82832.
41. Chen SA, Tai CT, Yu WC, et al. Right atrial focal atrial fibrillation: electrophysiologic characteristics and radiofrequency catheter ablation. J Cardiovasc Electrophysiol 1999;10:32835.
42. Jais P, Hocini M, Macle L, et al. Distinctive electrophysiological properties of pulmonary veins in patients with atrial fibrillation. Circulation 2002;106:247985.
43. Shah D, Haissaguerre M, Jais P, et al. Nonpulmonary vein foci: do they exist? Pacing Clin Electrophysiol 2003;26:16315.
44. Ortiz J, Niwano S, Abe H, et al. Mapping the conversion of atrial flutter to atrial fibrillation and atrial fibrillation to atrial flutter: insights into mechanism. Circ Res 1994;74:882894.
45. Konings KT, Kirchof CJ, Smeets JR, et al. High-density mapping of electrically induced atrial fibrillation in humans. Circulation 1994; 89:166580.
46. Moe GK, Abildskov JA. Atrial fibrillation as a self sustaining arrhythmia independent of focal discharge. Am Heart J 1959;58:5970.
47. Cox JL, Canavan TE, Schuessler RB, et al. The surgical treatment of atrial fibrillation. II. Intraoperative electrophysiologic mapping and description of the electrophysiologic basis of atrial flutter and atrial fibrillation. J Thorac Cardiovasc Surg 1991;101:40626.
47a. Mandapati R, Skanes A, Chen J, et al. Stable microreentrant sources as a mechanism of atrial fibrillation in the isolated sheep heart. Circulation 2000;101:19499.
47b. Lazar S, Dixit S, Marchlinski FE, et al. Presence of left-to-right atrial frequency gradient in paroxysmal but not persistent atrial fibrillation in humans. Circulation 2004;110:318186.
47c. Sanders P, Berenfeld O, Hocini M, et al. Spectral analysis identifies sites of high-frequency activity maintaining atrial fibrillation in humans. Circulation 2005;112:78997.
48. Nakao K, Seto S, Ueyama C, et al. Extended distribution of prolonged and fractionated right atrial electrograms predicts development of chronic atrial fibrillation in patients with idiopathic paroxysmal atrial fibrillation. J Cardiovasc Electrophysiol 2002;13:9961002.
49. Akyurek O, Sayin T, Dincer I, et al. Lengthening of intraatrial conduction time in atrial fibrillation and its relation with early recurrence of atrial fibrillation. Jpn Heart J 2001;42:57584.
50. Yamada T, Fukunami M, Shimonagata T, et al. Prediction of paroxysmal atrial fibrillation in patients with congestive heart failure: a prospective study. J Am Coll Cardiol 2000;35:40513.
51. Ricard P, Levy S, Trigano J, et al. Prospective assessment of the minimum energy needed for external electrical cardioversion of atrial fibrillation. Am J Cardiol 1997;79:8156.
52. Wijffels MC, Kirchhof CJ, Dorland R, et al. Atrial fibrillation begets atrial fibrillation. A study in awake chronically instrumented goats. Circulation 1995;92:195468.
53. Nattel S. New ideas about atrial fibrillation 50 years on. Nature 2002;415:21926.
54. Anne W, Willems R, Van der MN, et al. Atrial fibrillation after radiofrequency ablation of atrial flutter: preventive effect of angiotensin converting enzyme inhibitors, angiotensin II receptor blockers, and diuretics. Heart 2004;90:102530.
55. Healey JS, Baranchuk A, Crystal E, et al. Prevention of atrial fibrillation with angiotensin-converting enzyme inhibitors and angiotensin receptor blockers: a meta-analysis. J Am Coll Cardiol 2005;45:18329.
56. Pedersen OD, Bagger H, Kober L, et al. Trandolapril reduces the incidence of atrial fibrillation after acute myocardial infarction in patients with left ventricular dysfunction. Circulation 1999;100:37680.
57. Prystowsky EN. Atrioventricular node reentry: physiology and radiofrequency ablation. Pacing Clin Electrophysiol 1997;20:55271.
58. e RL, Wharton JM, Prystowsky EN. Effect of continuous vagal enhancement on concealed conduction and refractoriness within the atrioventricular node. Am J Cardiol 1996;77:2605.
59. Moe GK, Abildskov JA. Observations on the ventricular dysrhythmia associated with atrial fibrillation in the dog heart. Circ Res 1964;4:44760.
60. Van Den Berg MP, Crijns HJ, Haaksma J, et al. Analysis of vagal effects on ventricular rhythm in patients with atrial fibrillation. Clin Sci (Colch) 1994;86:5315.
61. Klein GJ, Bashore TM, Sellers TD, et al. Ventricular fibrillation in the Wolff-Parkinson-White syndrome. N Engl J Med 1979;301:10805.
62. Prystowsky EN, Benson DW Jr, Fuster V, et al. Management of patients with atrial fibrillation. A statement for healthcare professionals. From the Subcommittee on Electrocardiography and Electrophysiology, American Heart Association. Circulation 1996;93:126277.
63. Brookes CI, White PA, Staples M, et al. Myocardial contractility is not constant during spontaneous atrial fibrillation in patients. Circulation 1998;98:17628.
64. Sanfilippo AJ, Abascal VM, Sheehan M, et al. Atrial enlargement as a consequence of atrial fibrillation. A prospective echocardiographic study. Circulation 1990;82:7927.
65. Gosselink AT, Crijns HJ, Hamer HP, et al. Changes in left and right atrial size after cardioversion of atrial fibrillation: role of mitral valve disease. J Am Coll Cardiol 1993;22:166672.
66. Manning WJ, Silverman DI, Katz SE, et al. Impaired left atrial mechanical function after cardioversion: relation to the duration of atrial fibrillation. J Am Coll Cardiol 1994;23:153540.
67. Van Den Berg MP, Tuinenburg AE, van Veldhuisen DJ, et al. Cardioversion of atrial fibrillation in the setting of mild to moderate heart failure. Int J Cardiol 1998;63:6370.
68. Packer DL, Bardy GH, Worley SJ, et al. Tachycardia-induced cardiomyopathy: a reversible form of left ventricular dysfunction. Am J Cardiol 1986;57:56370.
69. Shinbane JS, Wood MA, Jensen DN, et al. Tachycardia-induced cardiomyopathy: a review of animal models and clinical studies. J Am Coll Cardiol 1997;29:70915.
70. Halperin JL, Hart RG. Atrial fibrillation and stroke: new ideas, persisting dilemmas. Stroke 1988;19:93741.
71. Bogousslavsky J, Van Melle G, Regli F, et al. Pathogenesis of anterior circulation stroke in patients with nonvalvular atrial fibrillation: the Lausanne Stroke Registry. Neurology 1990;40:104650.
72. Miller VT, Rothrock JF, Pearce LA, et al. Ischemic stroke in patients with atrial fibrillation: effect of aspirin according to stroke mechanism. Stroke Prevention in Atrial Fibrillation Investigators. Neurology 1993;43:326.
73. Kanter MC, Tegeler CH, Pearce LA, et al. Carotid stenosis in patients with atrial fibrillation. Prevalence, risk factors, and relationship to stroke in the Stroke Prevention in Atrial Fibrillation Study. Arch Intern Med 1994;154:13727.
74. Hart RG, Halperin JL. Atrial fibrillation and stroke: concepts and controversies. Stroke 2001;32:8038.
75. Aschenberg W, Schluter M, Kremer P, et al. Transesophageal twodimensional echocardiography for the detection of left atrial appendage thrombus. J Am Coll Cardiol 1986;7:1636.
76. Mugge A, Kuhn H, Nikutta P, et al. Assessment of left atrial appendage function by bie transesophageal echocardiography in patients with nonrheumatic atrial fibrillation: identification of a subgroup of patients at increased embolic risk. J Am Coll Cardiol 1994;23:599607.
77. Manning WJ, Leeman DE, Gotch PJ, et al. Pulsed Doppler evaluation of atrial mechanical function after electrical cardioversion of atrial fibrillation. J Am Coll Cardiol 1989;13:61723.
78. Grimm RA, Stewart WJ, Maloney JD, et al. Impact of electrical cardioversion for atrial fibrillation on left atrial appendage function and spontaneous echo contrast: characterization by simultaneous transesophageal echocardiography. J Am Coll Cardiol 1993;22:135966.
79. Chimowitz MI, DeGeorgia MA, Poole RM, et al. Left atrial spontaneous echo contrast is highly associated with previous stroke in patients with atrial fibrillation or mitral stenosis. Stroke 1993;24:10159.
80. Stoddard MF, Dawkins PR, Prince CR, et al. Left atrial appendage thrombus is not uncommon in patients with acute atrial fibrillation and a recent embolic event: a transesophageal echocardiographic study. J Am Coll Cardiol 1995;25:4529.
81. Manning WJ, Silverman DI, Waksmonski CA, et al. Prevalence of residual left atrial thrombi among patients with acute thromboembolism and newly recognized atrial fibrillation. Arch Intern Med 1995;155:21938.
82. Khan IA. Atrial stunning: determinants and cellular mechanisms. Am Heart J 2003;145:78794.
83. Dunn MI, Marcum JL. Atrial mechanical performance following internal and external cardioversion of atrial fibrillation: its relationship to peripheral embolization and acute cerebrovascular accident. Chest 2002;121:13.
84. Berger M, Schweitzer P. Timing of thromboembolic events after electrical cardioversion of atrial fibrillation or flutter: a retrospective analysis. Am J Cardiol 1998;82:15457, A8.
85. Collins LJ, Silverman DI, Douglas PS, et al. Cardioversion of nonrheumatic atrial fibrillation. Reduced thromboembolic complications with 4 weeks of precardioversion anticoagulation are related to atrial thrombus resolution. Circulation 1995;92:1603.
86. Fatkin D, Kelly RP, Feneley MP. Relations between left atrial appendage blood flow velocity, spontaneous echocardiographic contrast and thromboembolic risk in vivo. J Am Coll Cardiol 1994;23:9619.
87. Black IW, Chesterman CN, Hopkins AP, et al. Hematologic correlates of left atrial spontaneous echo contrast and thromboembolism in nonvalvular atrial fibrillation. J Am Coll Cardiol 1993;21:4517.
88. Yang Y, Grosset DG, Li Q, et al. Identification of echocardiographic smoke in a bench model with transcranial Doppler ultrasound. Stroke 2000;31:90714.
89. Agarwal AK, Venugopalan P. Left atrial spontaneous echo contrast in patients with rheumatic mitral valve stenosis in sinus rhythm: relationship to mitral valve and left atrial measurements. Int J Cardiol 2001;77:638.
90. Black IW. Spontaneous echo contrast: where theres smoke theres fire. Echocardiography 2000;17:37382.
91. Sparks PB, Jayaprakash S, Vohra JK, et al. Left atrial stunning following radiofrequency catheter ablation of chronic atrial flutter. J Am Coll Cardiol 1998;32:46875.
92. Hart RG, Pearce LA, Miller VT, et al. Cardioembolic vs. noncardioembolic strokes in atrial fibrillation: frequency and effect of antithrombotic agents in the stroke prevention in atrial fibrillation studies. Cerebrovasc Dis 2000;10:3943.
93. Blackshear JL, Pearce LA, Hart RG, et al. Aortic plaque in atrial fibrillation: prevalence, predictors, and thromboembolic implications. Stroke 1999;30:83440.
94. Fang MC, Singer DE, Chang Y, et al. Gender differences in the risk of ischemic stroke and peripheral embolism in atrial fibrillation: the Anticoagulation and Risk factors In Atrial fibrillation (ATRIA) study. Circulation 2005;112:168791.
95. Yoshida M, Nakamura Y, Higashikawa M, Kinoshita M. Predictors of ischemic stroke in non-rheumatic atrial fibrillation. Int J Cardiol 1996;56:6170.
96. Hart RG, Pearce LA, McBride R, et al. Factors associated with ischemic stroke during aspirin therapy in atrial fibrillation: analysis of 2012 participants in the SPAF I-III clinical trials. The Stroke Prevention in Atrial Fibrillation (SPAF) Investigators. Stroke 1999;30:12239.
97. Stollberger C, Chnupa P, Kronik G, et al. Transesophageal echocardiography to assess embolic risk in patients with atrial fibrillation. ELAT Study Group. Embolism in Left Atrial Thrombi. Ann Intern Med 1998;128:6308.
98. Tsai LM, Lin LJ, Teng JK, et al. Prevalence and clinical significance of left atrial thrombus in nonrheumatic atrial fibrillation. Int J Cardiol 1997;58:1639.
99. Rathore SS, Berger AK, Weinfurt KP, et al. Acute myocardial infarction complicated by atrial fibrillation in the elderly: prevalence and outcomes. Circulation 2000;101:96974.
100. Goldberg RJ, Yarzebski J, Lessard D, et al. Recent trends in the incidence rates of and death rates from atrial fibrillation complicating initial acute myocardial infarction: a community-wide perspective. Am Heart J 2002;143:51927.
101. Prystowsky EN. Tachycardia-induced-tachycardia: a mechanism of initiation of atrial fibrillation. In: DiMarco JP, Prystowsky EN, editors. Atrial Arrhythmias: State of the Art Armonk, NY: Futura, 1995.
102. Brugada R, Tapscott T, Czernuszewicz GZ, et al. Identification of a genetic locus for familial atrial fibrillation. N Engl J Med 1997;336:90511.
103. Frost L, Hune LJ, Vestergaard P. Overweight and obesity as risk factors for atrial fibrillation or flutter: the Danish Diet, Cancer, and Health Study. Am J Med 2005;118:48995.
104. Wang TJ, Parise H, Levy D, et al. Obesity and the risk of new-onset atrial fibrillation. JAMA 2004;292:24717.
105. Fox CS, Parise H, DAgostino RB Sr, et al. Parental atrial fibrillation as a risk factor for atrial fibrillation in offspring. JAMA 2004;291:28515.
106. Ellinor PT, Shin JT, Moore RK, et al. Locus for atrial fibrillation maps to chromosome 6q1416. Circulation 2003;107:28803.
107. Darbar D, Herron KJ, Ballew JD, et al. Familial atrial fibrillation is a genetically heterogeneous disorder. J Am Coll Cardiol 2003;41: 218592.
108. Fioranelli M, Piccoli M, Mileto GM, et al. Analysis of heart rate variability five minutes before the onset of paroxysmal atrial fibrillation. Pacing Clin Electrophysiol 1999;22:7439.
109. Herweg B, Dalal P, Nagy B, et al. Power spectral analysis of heart period variability of preceding sinus rhythm before initiation of paroxysmal atrial fibrillation. Am J Cardiol 1998;82:86974.
110. Coumel P. Neural aspects of paroxysmal atrial fibrillation. In: Falk RH, Podrid PJ, editors. Atrial Fibrillation: Mechanisms and Management. New York: Raven Press, 1992:10925.
111. Maisel WH. Autonomic modulation preceding the onset of atrial fibrillation. J Am Coll Cardiol 2003;42:126970.
112. Fetsch T, Bauer P, Engberding R, et al. Prevention of atrial fibrillation after cardioversion: results of the PAFAC trial. Eur Heart J 2004;25:138594.
113. Israel CW, Gronefeld G, Ehrlich JR, et al. Long-term risk of recurrent atrial fibrillation as documented by an imtable monitoring device: implications for optimal patient care. J Am Coll Cardiol 2004;43:4752.
114. e RL, Wilkinson WE, Clair WK, et al. Asymptomatic arrhythmias in patients with symptomatic paroxysmal atrial fibrillation and paroxysmal supraventricular tachycardia. Circulation 1994;89:2247.
115. Kerr CR, Boone J, Connolly SJ, et al. The Canadian Registry of Atrial Fibrillation: a noninterventional follow-up of patients after the first diagnosis of atrial fibrillation. Am J Cardiol 1998;82:82N-5N.
116. Singh BN, Singh SN, Reda DJ, et al. Amiodarone versus sotalol for atrial fibrillation. N Engl J Med 2005;352:186172.
117. Hamer ME, Blumenthal JA, McCarthy EA, et al. Quality-of-life assessment in patients with paroxysmal atrial fibrillation or paroxysmal supraventricular tachycardia. Am J Cardiol 1994;74:8269.
118. Savelieva I, Camm AJ. Clinical relevance of silent atrial fibrillation: prevalence, prognosis, quality of life, and management. J Interv Card Electrophysiol 2000;4:36982.
119. Krahn AD, Klein GJ, Kerr CR, et al. How useful is thyroid function testing in patients with recent-onset atrial fibrillation? The Canadian Registry of Atrial Fibrillation Investigators. Arch Intern Med 1996;156:22214.
120. Zabalgoitia M, Halperin JL, Pearce LA, et al. Transesophageal echocardiographic correlates of clinical risk of thromboembolism in nonvalvular atrial fibrillation. Stroke Prevention in Atrial Fibrillation III Investigators. J Am Coll Cardiol 1998;31:16226.
121. Healey JS, Crystal E, Lamy A, et al. Left Atrial Appendage Occlusion Study (LAAOS): results of a randomized controlled pilot study of left atrial appendage occlusion during coronary bypass surgery in patients at risk for stroke. Am Heart J 2005;150:28893.
122. Sherman DG, Kim SG, Boop BS, et al. Occurrence and characteristics of stroke events in the Atrial Fibrillation Follow-up Investigation of Sinus Rhythm Management (AFFIRM) study. Arch Intern Med 2005;165:118591.
123. Deleted in proof.
124. Van Gelder IC, Hagens VE, Bosker HA, et al. A ison of rate control and rhythm control in patients with recurrent persistent atrial fibrillation. N Engl J Med 2002;347:183440.
125. Gronefeld GC, Lilienthal J, Kuck KH, et al. Impact of rate versus rhythm control on quality of life in patients with persistent atrial fibrillation. Results from a prospective randomized study. Eur Heart J 2003;24:14306.
126. Carlsson J, Miketic S, Windeler J, et al. Randomized trial of rate control versus rhythm-control in persistent atrial fibrillation: the Strategies of Treatment of Atrial Fibrillation (STAF) study. J Am Coll Cardiol 2003;41:16906.
127. Opolski G, Torbicki A, Kosior DA, et al. Rate control vs. rhythm control in patients with nonvalvular persistent atrial fibrillation: the results of the Polish How to Treat Chronic Atrial Fibrillation (HOT CAFE) Study. Chest 2004;126:47686.
128. Wyse DG, Waldo AL, DiMarco JP, et al. A ison of rate control and rhythm control in patients with atrial fibrillation. N Engl J Med 2002;347:182533.
129. Pelargonio G, Prystowsky EN. Rate versus rhythm control in the management of patients with atrial fibrillation. Nat Clin Pract Cardiovasc Med 2005;2:51421.
130. Hohnloser SH, Kuck KH, Lilienthal J. Rhythm or rate control in atrial fibrillationPharmacological Intervention in Atrial Fibrillation (PIAF): a randomised trial. Lancet 2000;356:178994.
131. Hagens VE, Ranchor AV, Van SE, et al. Effect of rate or rhythm control on quality of life in persistent atrial fibrillation. Results from the Rate Control Versus Electrical Cardioversion (RACE) Study. J Am Coll Cardiol 2004;43:2417.
132. Cooper HA, Bloomfield DA, Bush DE, et al. Relation between achieved heart rate and outcomes in patients with atrial fibrillation (from the Atrial Fibrillation Follow-up Investigation of Rhythm Management [AFFIRM] Study). Am J Cardiol 2004;93:124753.
133. Lonnerholm S, Blomstrom P, Nilsson L, et al. Effects of the maze operation on health-related quality of life in patients with atrial fibrillation. Circulation 2000;101:260711.
134. Oral H, Pappone C, Chugh A, et al. Circumferential pulmonary-vein ablation for chronic atrial fibrillation. N Engl J Med 2006;354:93441.
135. Levy S, Ricard P, Lau CP, et al. Multicenter low energy transvenous atrial defibrillation (XAD) trial results in different subsets of atrial fibrillation. J Am Coll Cardiol 1997;29:7505.
136. Lown B, Amarasingham R, Neuman J. New method for terminating cardiac arrhythmias: use of synchronized capacitor discharge. JAMA 1962;182:54855.
137. Nerheim P, Birger-Botkin S, Piracha L, et al. Heart failure and sudden death in patients with tachycardia-induced cardiomyopathy and recurrent tachycardia. Circulation 2004;110:24752.
138. Petri H, Kafka W, Rudolph W. [Discrepant effects of oral and intravenous verapamil on A-V conduction in patients with ventricular preexcitation and atrial fibrillation]. Herz 1983;8:14452.
139. Wittkampf FH, de Jongste MJ, Lie HI, et al. Effect of right ventricular pacing on ventricular rhythm during atrial fibrillation. J Am Coll Cardiol 1988;11:53945.
140. Brignole M, Menozzi C, Gianfranchi L, et al. Assessment of atrioventricular junction ablation and VVIR pacemaker versus pharmacological treatment in patients with heart failure and chronic atrial fibrillation: a randomized, controlled study. Circulation 1998;98:95360.
141. Kay GN, Ellenbogen KA, Giudici M, et al. The Ablate and Pace Trial: a prospective study of catheter ablation of the AV conduction system and permanent pacemaker imtation for treatment of atrial fibrillation. APT Investigators. J Interv Card Electrophysiol 1998;2:12135.
142. Brignole M, Gianfranchi L, Menozzi C, et al. Assessment of atrioventricular junction ablation and DDDR mode-switching pacemaker versus pharmacological treatment in patients with severely symptomatic paroxysmal atrial fibrillation: a randomized controlled study. Circulation 1997;96:261724.
143. Wood MA, Brown-Mahoney C, Kay GN, et al. Clinical outcomes after ablation and pacing therapy for atrial fibrillation: a meta-analysis. Circulation 2000;101:113844.
144. Williamson BD, Man KC, Daoud E, et al. Radiofrequency catheter modification of atrioventricular conduction to control the ventricular rate during atrial fibrillation [published erratum appears in N Engl J Med 1995;332:479]. N Engl J Med 1994;331:9107.
145. Feld GK, Fleck RP, Fujimura O, et al. Control of rapid ventricular response by radiofrequency catheter modification of the atrioventricular node in patients with medically refractory atrial fibrillation. Circulation 1994;90:2299307.
146. Evans GT Jr, Scheinman MM, Bardy G, et al. Predictors of in-hospital mortality after DC catheter ablation of atrioventricular junction. Results of a prospective, international, multicenter study. Circulation 1991;84:192437.
147. Leon AR, Greenberg JM, Kanuru N, et al. Cardiac resynchronization in patients with congestive heart failure and chronic atrial fibrillation: effect of upgrading to biventricular pacing after chronic right ventricular pacing. J Am Coll Cardiol 2002;39:125863.
148. Hart RG, Pearce LA, Rothbart RM, et al. Stroke with intermittent atrial fibrillation: incidence and predictors during aspirin therapy. Stroke Prevention in Atrial Fibrillation Investigators. J Am Coll Cardiol 2000;35:1837.
149. Adjusted-dose warfarin versus low-intensity, fixed-dose warfarin plus aspirin for high-risk patients with atrial fibrillation: Stroke Prevention in Atrial Fibrillation III randomised clinical trial. Lancet 1996;348:6338.
150. Landefeld CS, Goldman L. Major bleeding in outpatients treated with warfarin: incidence and prediction by factors known at the start of outpatient therapy. Am J Med 1989;87:14452.
151. Moulton AW, Singer DE, Haas JS. Risk factors for stroke in patients with nonrheumatic atrial fibrillation: a case-control study. Am J Med 1991;91:15661.
152. Gage BF, Waterman AD, Shannon W, et al. Validation of clinical classification schemes for predicting stroke: results from the National Registry of Atrial Fibrillation. JAMA 2001;285:286470.
153. van Walraven WC, Hart RG, Wells GA, et al. A clinical prediction rule to identify patients with atrial fibrillation and a low risk for stroke while taking aspirin. Arch Intern Med 2003;163:93643.
154. Patients with nonvalvular atrial fibrillation at low risk of stroke during treatment with aspirin: Stroke Prevention in Atrial Fibrillation III Study. The SPAF III Writing Committee for the Stroke Prevention in Atrial Fibrillation Investigators. JAMA 1998;279:12737.
155. Howitt A, Armstrong D. Implementing evidence based medicine in general practice: audit and qualitative study of antithrombotic treatment for atrial fibrillation. BMJ 1999;318:13247.
156. Biblo LA, Yuan Z, Quan KJ, et al. Risk of stroke in patients with atrial flutter. Am J Cardiol 2001;87:3469, A9.
157. Petersen P, Boysen G, Godtfredsen J, et al. Placebo-controlled, randomised trial of warfarin and aspirin for prevention of thromboembolic complications in chronic atrial fibrillation. The Copenhagen AFASAK study. Lancet 1989;1:1759.
158. Connolly SJ, Laupacis A, Gent M, et al. Canadian Atrial Fibrillation Anticoagulation (CAFA) Study. J Am Coll Cardiol 1991;18:34955.
159. Ezekowitz MD, Bridgers SL, James KE, et al. Warfarin in the prevention of stroke associated with nonrheumatic atrial fibrillation. Veterans Affairs Stroke Prevention in Nonrheumatic Atrial Fibrillation Investigators [published erratum appears in N Engl J Med 1993;328:148]. N Engl J Med 1992;327:140612.
160. The effect of low-dose warfarin on the risk of stroke in patients with nonrheumatic atrial fibrillation. The Boston Area Anticoagulation Trial for Atrial Fibrillation Investigators. N Engl J Med 1990;323:150511.
161. Stroke Prevention in Atrial Fibrillation Study. Final results. Circulation 1991;84:52739.
162. Deleted in proof.
163. Deleted in proof.
164. Secondary prevention in non-rheumatic atrial fibrillation after transient ischaemic attack or minor stroke. EAFT (European Atrial Fibrillation Trial) Study Group. Lancet 1993;342:125562.
165. Hart RG, Benavente O, McBride R, et al. Antithrombotic therapy to prevent stroke in patients with atrial fibrillation: a meta-analysis. Ann Intern Med 1999;131:492501.
166. Hylek EM, Singer DE. Risk factors for intracranial hemorrhage in outpatients taking warfarin. Ann Intern Med 1994;120:897902.
167. Oden A, Fahlen M, Hart RG. Optimal INR for prevention of stroke and death in atrial fibrillation: a critical appraisal. Thromb Res 2006;117:4939
168. Fihn SD, Callahan CM, Martin DC, et al. The risk for and severity of bleeding complications in elderly patients treated with warfarin. The National Consortium of Anticoagulation Clinics. Ann Intern Med 1996;124:9709.
169. Fang MC, Chang Y, Hylek EM, et al. Advanced age, anticoagulation intensity, and risk for intracranial hemorrhage among patients taking warfarin for atrial fibrillation. Ann Intern Med 2004;141:74552.
170. Hylek EM, Go AS, Chang Y, et al. Effect of intensity of oral anticoagulation on stroke severity and mortality in atrial fibrillation. N Engl J Med 2003;349:101926.
171. Hart RG, Tonarelli SB, Pearce LA. Avoiding central nervous system bleeding during antithrombotic therapy: recent data and ideas. Stroke 2005;36:158893.
172. Albers GW, Diener HC, Frison L, et al. Ximelagatran vs. warfarin for stroke prevention in patients with nonvalvular atrial fibrillation: a randomized trial. JAMA 2005;293:6908.
173. Hylek EM, Skates SJ, Sheehan MA, et al. An analysis of the lowest effective intensity of prophylactic anticoagulation for patients with nonrheumatic atrial fibrillation. N Engl J Med 1996;335:5406.
174. Gullov AL, Koefoed BG, Petersen P. Bleeding during warfarin and aspirin therapy in patients with atrial fibrillation: the AFASAK 2 study. Atrial Fibrillation Aspirin and Anticoagulation. Arch Intern Med 1999;159:13228.
175. Hellemons BS, Langenberg M, Lodder J, et al. Primary prevention of arterial thromboembolism in non-rheumatic atrial fibrillation in primary care: randomised controlled trial ing two intensities of coumarin with aspirin. BMJ 1999;319:95864.
176. Warfarin versus aspirin for prevention of thromboembolism in atrial fibrillation: Stroke Prevention in Atrial Fibrillation II Study. Lancet 1994;343:68791.
177. Diener HC, Cunha L, Forbes C. et al. European Stroke Prevention Study-2 (ESPS-2). Dipyridamole and acetylsalicylic acid in the secondary prevention of stroke. J Neurol Sci 1996;143:113.
178. European Stroke Prevention Study. ESPS Group. Stroke 1990;21:112230.
179. Posada IS, Barriales V. Alternate-day dosing of aspirin in atrial fibrillation. LASAF Pilot Study Group. Am Heart J 1999;138:13743.
180. Farrell B, Godwin J, Richards S, et al. The United Kingdom transient ischaemic attack (UK-TIA) aspirin trial: final results. J Neurol Neurosurg Psychiatry 1991;54:104454.
181. The efficacy of aspirin in patients with atrial fibrillation. Analysis of pooled data from 3 randomized trials. The Atrial Fibrillation Investigators. Arch Intern Med 1997;157:123740.
182. Deleted in proof.
183. Hart RG, Benavente O, Pearce LA. Increased risk of intracranial hemorrhage when aspirin is combined with warfarin: a meta-analysis and hypothesis. Cerebrovasc Dis 1999;9:2157.
184. Stellbrink C, Nixdorff U, Hofmann T, et al. Safety and efficacy of enoxaparin ed with unfractionated heparin and oral anticoagulants for prevention of thromboembolic complications in cardioversion of nonvalvular atrial fibrillation: the Anticoagulation in Cardioversion using Enoxaparin (ACE) trial. Circulation 2004;109:9971003.
185. Hirsh J, Warkentin TE, Shaughnessy SG, et al. Heparin and low-molecular-weight heparin: mechanisms of action, pharmacokinetics, dosing, monitoring, efficacy, and safety. Chest 2001;119:64S94S.
186. Murray RD, Deitcher SR, Shah A, et al. Potential clinical efficacy and cost benefit of a transesophageal echocardiography-guidedlow-molecular-weight heparin (enoxaparin) approach to antithrombotic therapy in patients undergoing immediate cardioversion from atrial fibrillation. J Am Soc Echocardiogr 2001;14:2008.
187. Stein PD, Alpert JS, Bussey HI, et al. Antithrombotic therapy in patients with mechanical and biological prosthetic heart valves. Chest 2001;119:220S7S.
188. Blackshear JL, Johnson WD, Odell JA, et al. Thoracoscopic extracardiac obliteration of the left atrial appendage for stroke risk reduction in atrial fibrillation. J Am Coll Cardiol 2003;42:124952.
189. Ostermayer SH, Reisman M, Kramer PH, et al. Percutaneous left atrial appendage transcatheter occlusion (PLAATO system) to prevent stroke in high-risk patients with non-rheumatic atrial fibrillation: results from the international multi-center feasibility trials. J Am Coll Cardiol 2005;46:914.
190. Halperin JL, Gomberg-Maitland M. Obliteration of the left atrial appendage for prevention of thromboembolism. J Am Coll Cardiol 2003;42:125961.
191. Suttorp MJ, Kingma JH, Jessurun ER, et al. The value of class IC antiarrhythmic drugs for acute conversion of paroxysmal atrial fibrillation or flutter to sinus rhythm. J Am Coll Cardiol 1990;16:17227.
192. Platia EV, Michelson EL, Porterfield JK, et al. Esmolol versus verapamil in the acute treatment of atrial fibrillation or atrial flutter. Am J Cardiol 1989;63:9259.
193. Azpitarte J, Alvarez M, Baun O, et al. Value of single oral loading dose of propafenone in converting recent-onset atrial fibrillation. Results of a randomized, double-blind, controlled study. Eur Heart J 1997;18:164954.
194. Kochiadakis GE, Igoumenidis NE, Solomou MC, et al. Efficacy of amiodarone for the termination of persistent atrial fibrillation. Am J Cardiol 1999;83:5861.
195. Capucci A, Boriani G, Rubino I, et al. A controlled study on oral propafenone versus digoxin plus quinidine in converting recent onset atrial fibrillation to sinus rhythm. Int J Cardiol 1994;43:30513.
196. Vaughan Williams EM. A classification of antiarrhythmic actions reassessed after a decade of new drugs. J Clin Pharmacol 1984;24:12947.
197. Falk RH, Pollak A, Singh SN, et al. Intravenous dofetilide, a class III antiarrhythmic agent, for the termination of sustained atrial fibrillation or flutter. Intravenous Dofetilide Investigators. J Am Coll Cardiol 1997;29:38590.
198. Norgaard BL, Wachtell K, Christensen PD, et al. Efficacy and safety of intravenously administered dofetilide in acute termination of atrial fibrillation and flutter: a multicenter, randomized, double-blind, placebo-controlled trial. Danish Dofetilide in Atrial Fibrillation and Flutter Study Group. Am Heart J 1999;137:10629.
199. Sedgwick ML, Lip G, Rae AP, et al. Chemical cardioversion of atrial fibrillation with intravenous dofetilide. Int J Cardiol 1995;49:15966.
200. Torp-Pedersen C, Moller M, Bloch-Thomsen PE, et al. Dofetilide in patients with congestive heart failure and left ventricular dysfunction. Danish Investigations of Arrhythmia and Mortality on Dofetilide Study Group. N Engl J Med 1999;341:85765.
201. Lindeboom JE, Kingma JH, Crijns HJ, et al. Efficacy and safety of intravenous dofetilide for rapid termination of atrial fibrillation and atrial flutter. Am J Cardiol 2000;85:10313.
202. Singh S, Zoble RG, Yellen L, et al. Efficacy and safety of oral dofetilide in converting to and maintaining sinus rhythm in patients with chronic atrial fibrillation or atrial flutter: the symptomatic atrial fibrillation investigative research on dofetilide (SAFIRE-D) study. Circulation 2000;102:238590.
203. Borgeat A, Goy JJ, Maendly R, et al. Flecainide versus quinidine for conversion of atrial fibrillation to sinus rhythm. Am J Cardiol 1986;58:4968.
204. Suttorp MJ, Kingma JH, Lie AH, et al. Intravenous flecainide versus verapamil for acute conversion of paroxysmal atrial fibrillation or flutter to sinus rhythm. Am J Cardiol 1989;63:6936.
205. Capucci A, Lenzi T, Boriani G, et al. Effectiveness of loading oral flecainide for converting recent-onset atrial fibrillation to sinus rhythm in patients without organic heart disease or with only systemic hypertension. Am J Cardiol 1992;70:6972.
206. Donovan KD, Power BM, Hockings BE, et al. Intravenous flecainide versus amiodarone for recent-onset atrial fibrillation. Am J Cardiol 1995;75:6937.
207. Botto GL, Bonini W, Broffoni T, et al. Regular ventricular rhythms before conversion of recent onset atrial fibrillation to sinus rhythm. Pacing Clin Electrophysiol 1994;17:21147.
208. Donovan KD, Dobb GJ, Coombs LJ, et al. Reversion of recent-onset atrial fibrillation to sinus rhythm by intravenous flecainide. Am J Cardiol 1991;67:13741.
209. Barranco F, Sanchez M, Rodriguez J, et al. Efficacy of flecainide in patients with supraventricular arrhythmias and respiratory insufficiency. Intensive Care Med 1994;20:424.
210. Baldi N, Russo VA, Lenti V, et al. Relation between plasma levels and efficacy of flecainide and propafenone for treatment of atrial fibrillation of recent onset. New Trends Arrhythmias 1993;9:899906.
211. Stambler BS, Wood MA, Ellenbogen KA. Antiarrhythmic actions of intravenous ibutilide ed with procainamide during human atrial flutter and fibrillation: electrophysiological determinants of enhanced conversion efficacy. Circulation 1997;96:4298306.
212. Guo GB, Ellenbogen KA, Wood MA, et al. Conversion of atrial flutter by ibutilide is associated with increased atrial cycle length variability. J Am Coll Cardiol 1996;27:10839.
213. Volgman AS, Carberry PA, Stambler B, et al. Conversion efficacy and safety of intravenous ibutilide ed with intravenous procainamide in patients with atrial flutter or fibrillation. J Am Coll Cardiol 1998;31:14149.
214. Vos MA, Golitsyn SR, Stangl K, et al. Superiority of ibutilide (a new class III agent) over DL-sotalol in converting atrial flutter and atrial fibrillation. The Ibutilide/Sotalol Comparator Study Group. Heart 1998;79:56875.
215. Stambler BS, Wood MA, Ellenbogen KA, et al. Efficacy and safety of repeated intravenous doses of ibutilide for rapid conversion of atrial flutter or fibrillation. Ibutilide Repeat Dose Study Investigators. Circulation 1996;94:161321.
216. Ellenbogen KA, Stambler BS, Wood MA, et al. Efficacy of intravenous ibutilide for rapid termination of atrial fibrillation and atrial flutter: a dose-response study [published erratum appears in J Am Coll Cardiol 1996;28:1082]. J Am Coll Cardiol 1996;28:1306.
217. Bertini G, Conti A, Fradella G, et al. Propafenone versus amiodarone in field treatment of primary atrial tachydysrhythmias. J Emerg Med 1990;8:1520.
218. Boriani G, Capucci A, Lenzi T, et al. Propafenone for conversion of recent-onset atrial fibrillation. A controlled ison between oral loading dose and intravenous administration. Chest 1995;108:3558.
219. Boriani G, Biffi M, Capucci A, et al. Oral propafenone to convert recent-onset atrial fibrillation in patients with and without underlying heart disease. A randomized, controlled trial. Ann Intern Med 1997;126:6215.
220. Fresco C, Proclemer A, Pavan A, et al. Intravenous propafenone in paroxysmal atrial fibrillation: a randomized, placebo-controlled, doubleblind, multicenter clinical trial. Paroxysmal Atrial Fibrillation Italian Trial (PAFIT)-2 Investigators. Clin Cardiol 1996;19:40912.
221. Stroobandt R, Stiels B, Hoebrechts R. Propafenone for conversion and prophylaxis of atrial fibrillation. Propafenone Atrial Fibrillation Trial Investigators. Am J Cardiol 1997;79:41823.
222. Bellandi F, Cantini F, Pedone T, et al. Effectiveness of intravenous propafenone for conversion of recent-onset atrial fibrillation: a placebocontrolled study. Clin Cardiol 1995;18:6314.
223. Bianconi L, Mennuni M, Lukic V, et al. Effects of oral propafenone administration before electrical cardioversion of chronic atrial fibrillation: a placebo-controlled study. J Am Coll Cardiol 1996;28:7006.
224. Weiner P, Ganam R, Ganem R, et al. Clinical course of recent-onset atrial fibrillation treated with oral propafenone. Chest 1994;105:10136.
225. Di Benedetto S. Quinidine versus propafenone for conversion of atrial fibrillation to sinus rhythm. Am J Cardiol 1997;80:5189.
226. Vita JA, Friedman PL, Cantillon C, et al. Efficacy of intravenous propafenone for the acute management of atrial fibrillation. Am J Cardiol 1989;63:12758.
227. Barroffio R, Tisi G, Guzzini F, et al. A randomised study ing digoxin and propafenone in the treatment of recent onset atrial fibrillation. Clin Drug Invest 1995;9:27783.
228. Galve E, Rius T, Ballester R, et al. Intravenous amiodarone in treatment of recent-onset atrial fibrillation: results of a randomized, controlled study. J Am Coll Cardiol 1996;27:107982.
229. Peuhkurinen K, Niemela M, Ylitalo A, et al. Effectiveness of amiodarone as a single oral dose for recent-onset atrial fibrillation. Am J Cardiol 2000;85:4625.
230. Zehender M, Hohnloser S, Muller B, et al. Effects of amiodarone versus quinidine and verapamil in patients with chronic atrial fibrillation: results of a ative study and a 2-year follow-up. J Am Coll Cardiol 1992;19:10549.
231. Hou ZY, Chang MS, Chen CY, et al. Acute treatment of recent-onset atrial fibrillation and flutter with a tailored dosing regimen of intravenous amiodarone. A randomized, digoxin-controlled study. Eur Heart J 1995;16:5218.
232. Opolski G, Stanislawska J, Gorecki A, et al. Amiodarone in restoration and maintenance of sinus rhythm in patients with chronic atrial fibrillation after unsuccessful direct-current cardioversion. Clin Cardiol 1997;20:33740.
233. Noc M, Stajer D, Horvat M. Intravenous amiodarone versus verapamil for acute conversion of paroxysmal atrial fibrillation to sinus rhythm. Am J Cardiol 1990;65:67980.
234. Tieleman RG, Gosselink AT, Crijns HJ, et al. Efficacy, safety, and determinants of conversion of atrial fibrillation and flutter with oral amiodarone. Am J Cardiol 1997;79:537.
235. Vardas PE, Kochiadakis GE, Igoumenidis NE, et al. Amiodarone as a first-choice drug for restoring sinus rhythm in patients with atrial fibrillation: a randomized, controlled study. Chest 2000;117:153845.
236. Kerin NZ, Faitel K, Naini M. The efficacy of intravenous amiodarone for the conversion of chronic atrial fibrillation. Amiodarone vs. quinidine for conversion of atrial fibrillation. Arch Intern Med 1996;156:4953.
237. Hohnloser SH, van de LA, Baedeker F. Efficacy and proarrhythmic hazards of pharmacologic cardioversion of atrial fibrillation: prospective ison of sotalol versus quinidine. J Am Coll Cardiol 1995;26:8528.
238. Halinen MO, Huttunen M, Paakkinen S, et al. Comparison of sotalol with digoxin-quinidine for conversion of acute atrial fibrillation to sinus rhythm (the Sotalol-Digoxin-Quinidine Trial). Am J Cardiol 1995;76:4958.
239. Madrid AH, Moro C, Marin-Huerta E, et al. Comparison of flecainide and procainamide in cardioversion of atrial fibrillation. Eur Heart J 1993;14:112731.
240. Deleted in proof.
241. Falk RH, Knowlton AA, Bernard SA, et al. Digoxin for converting recent-onset atrial fibrillation to sinus rhythm. A randomized, doubleblinded trial. Ann Intern Med 1987;106:5036.
242. Singh S, Saini RK, DiMarco J, et al. Efficacy and safety of sotalol in digitalized patients with chronic atrial fibrillation. The Sotalol Study Group. Am J Cardiol 1991;68:122730.
243. Jordaens L. Conversion of atrial fibrillation to sinus rhythm and rate control by digoxin in ison to placebo. Eur Heart J 1997;18:6438.
244. Deleted in proof.
245. Intravenous digoxin in acute atrial fibrillation. Results of a randomized, placebo-controlled multicentre trial in 239 patients. The Digitalis in Acute Atrial Fibrillation (DAAF) Trial Group. Eur Heart J 1997;18:64954.
246. Sung RJ, Tan HL, Karagounis L, et al. Intravenous sotalol for the termination of supraventricular tachycardia and atrial fibrillation and flutter: a multicenter, randomized, double-blind, placebo-controlled study. Sotalol Multicenter Study Group. Am Heart J 1995;129:73948.
247. Nakazawa H, Lythall DA, Noh J, et al. Is there a place for the late cardioversion of atrial fibrillation? A long-term follow-up study of patients with post-thyrotoxic atrial fibrillation. Eur Heart J 2000;21:32733.
248. Botto GL, Capucci A, Bonini W, et al. Conversion of recent onset atrial fibrillation to sinus rhythm using a single oral loading dose of propafenone: ison of two regimens. Int J Cardiol 1997;58:5561.
249. Deleted in proof.
250. Pilati G, Lenzi T, Trisolino G, et al. Amiodarone versus quinidine for conversion of recent onset atrial fibrillation to sinus rhythm. Curr Ther Res 1991;49:1406.
251. Alboni P, Botto GL, Baldi N, et al. Outpatient treatment of recent-onset atrial fibrillation with the pill-in-the-pocket approach. N Engl J Med 2004;351:238491.
252. Capucci A, Villani GQ, Piepoli MF, et al. The role of oral 1C antiarrhythmic drugs in terminating atrial fibrillation. Curr Opin Cardiol 1999;14:48.
253. Alboni P, Tomasi C, Menozzi C, et al. Efficacy and safety of out-of-hospital self-administered single-dose oral drug treatment in the management of infrequent, well-tolerated paroxysmal supraventricular tachycardia. J Am Coll Cardiol 2001;37:54853.
254. Capucci A, Villani GQ, Piepoli MF. Reproducible efficacy of loading oral propafenone in restoring sinus rhythm in patients with paroxysmal atrial fibrillation. Am J Cardiol 2003;92:13457.
255. Khan IA. Single oral loading dose of propafenone for pharmacological cardioversion of recent-onset atrial fibrillation. J Am Coll Cardiol 2001;37:5427.
256. Feld GK. Atrial fibrillation. Is there a safe and highly effective pharmacological treatment? Circulation 1990;82:224850.
257. Leitch JW, Klein GJ, Yee R, et al. Prognostic value of electrophysiology testing in asymptomatic patients with Wolff-Parkinson-White pattern [published erratum appears in Circulation 1991;83:1124]. Circulation 1990;82:171823.
258. Gosselink AT, Crijns HJ, Van Gelder IC, et al. Low-dose amiodarone for maintenance of sinus rhythm after cardioversion of atrial fibrillation or flutter. JAMA 1992;267:328993.
259. Hauser TH, Pinto DS, Josephson ME, et al. Safety and feasibility of a clinical pathway for the outpatient initiation of antiarrhythmic medications in patients with atrial fibrillation or atrial flutter. Am J Cardiol 2003;91:143741.
260. Levy S, Ricard P, Gueunoun M, et al. Low-energy cardioversion of spontaneous atrial fibrillation. Immediate and long-term results. Circulation 1997;96:2539.
261. Lesser MF. Safety and efficacy of in-office cardioversion for treatment of supraventricular arrhythmias. Am J Cardiol 1990;66:12678.
262. Joglar JA, Hamdan MH, Ramaswamy K, et al. Initial energy for elective external cardioversion of persistent atrial fibrillation. Am J Cardiol 2000;86:34850.
263. Wozakowska-Kaplon B, Janion M, Sielski J, et al. Efficacy of biphasic shock for transthoracic cardioversion of persistent atrial fibrillation: can we predict energy requirements? Pacing Clin Electrophysiol 2004;27:7648.
264. Bjerkelund CJ, Orning OM. The efficacy of anticoagulant therapy in preventing embolism related to D.C. electrical conversion of atrial fibrillation. Am J Cardiol 1969;23:20816.
265. Arnold AZ, Mick MJ, Mazurek RP, et al. Role of prophylactic anticoagulation for direct current cardioversion in patients with atrial fibrillation or atrial flutter. J Am Coll Cardiol 1992;19:8515.
266. Rabbino MD, Likoff W, Dreifus LS. Complications and limitations of direct current countershock. JAMA 1964;190:41720.
267. Lown B, Kleiger R, Williams J. Cardioversion and digitalis drugs: changed threshold to electric shock in digitalized animals. Circ Res 1965;17:51931.
268. Aberg H, Cullhed I. Direct current countershock complications. Acta Med Scand 1968;183:41521.
269. Mancini GB, Goldberger AL. Cardioversion of atrial fibrillation: consideration of embolization, anticoagulation, prophylactic pacemaker, and long-term success. Am Heart J 1982;104:61721.
270. Timmermans C, Rodriguez LM, Ayers GM, et al. Effect of electrode length on atrial defibrillation thresholds. J Cardiovasc Electrophysiol 1998;9:5827.
271. Tieleman RG, Van Gelder IC, Crijns HJ, et al. Early recurrences of atrial fibrillation after electrical cardioversion: a result of fibrillation-induced electrical remodeling of the atria? J Am Coll Cardiol 1998;31:16773.
272. Timmermans C, Rodriguez LM, Smeets JL, et al. Immediate reinitiation of atrial fibrillation following internal atrial defibrillation. J Cardiovasc Electrophysiol 1998;9:1228.
273. Rossi M, Lown B. The use of quinidine in cardioversion. Am J Cardiol 1967;19:2348.
274. Van Gelder IC, Crijns HJ, van Gilst WH, et al. Prediction of uneventful cardioversion and maintenance of sinus rhythm from direct-current electrical cardioversion of chronic atrial fibrillation and flutter. Am J Cardiol 1991;68:416.
275. Lundstrom T, Ryden L. Chronic atrial fibrillation. Long-term results of direct current conversion. Acta Med Scand 1988;223:539.
276. Niebauer MJ, Brewer JE, Chung MK, et al. Comparison of the rectilinear biphasic waveform with the monophasic damped sine waveform for external cardioversion of atrial fibrillation and flutter. Am J Cardiol 2004;93:14959.
277. Van Gelder IC, Crijns HJ, van Gilst WH, et al. Efficacy and safety of flecainide acetate in the maintenance of sinus rhythm after electrical cardioversion of chronic atrial fibrillation or atrial flutter. Am J Cardiol 1989;64:131721.
278. Crijns HJ, Van Gelder IC, Lie KI. Supraventricular tachycardia mimicking ventricular tachycardia during flecainide treatment. Am J Cardiol 1988;62:13036.
279. Van Gelder IC, Crijns HJ, van Gilst WH, et al. Effects of flecainide on the atrial defibrillation threshold. Am J Cardiol 1989;63:1124.
280. Oral H, Souza JJ, Michaud GF, et al. Facilitating transthoracic cardioversion of atrial fibrillation with ibutilide pretreatment. N Engl J Med 1999;340:184954.
281. Li H, Natale A, Tomassoni G, et al. Usefulness of ibutilide in facilitating successful external cardioversion of refractory atrial fibrillation. Am J Cardiol 1999;84:10968, A10.
282. Naccarelli GV, DellOrfano JT, Wolbrette DL, et al. Cost-effective management of acute atrial fibrillation: role of rate control, spontaneous conversion, medical and direct current cardioversion, transesophageal echocardiography, and antiembolic therapy. Am J Cardiol 2000;85:36D45D.
283. Manning WJ, Silverman DI, Gordon SP, et al. Cardioversion from atrial fibrillation without prolonged anticoagulation with use of transesophageal echocardiography to exclude the presence of atrial thrombi. N Engl J Med 1993;328:7505.
284. Black IW, Fatkin D, Sagar KB, et al. Exclusion of atrial thrombus by transesophageal echocardiography does not preclude embolism after cardioversion of atrial fibrillation. A multicenter study. Circulation 1994;89:250913.
285. Moreyra E, Finkelhor RS, Cebul RD. Limitations of transesophageal echocardiography in the risk assessment of patients before nonanticoagulated cardioversion from atrial fibrillation and flutter: an analysis of pooled trials. Am Heart J 1995;129:715.
286. Fatkin D, Kuchar DL, Thorburn CW, et al. Transesophageal echocardiography before and during direct current cardioversion of atrial fibrillation: evidence for atrial stunning as a mechanism of thromboembolic complications. J Am Coll Cardiol 1994;23:30716.
287. Antonielli E, Pizzuti A, Bassignana A, et al. Transesophageal echocardiographic evidence of more pronounced left atrial stunning after chemical (propafenone) rather than electrical attempts at cardioversion from atrial fibrillation. Am J Cardiol 1999;84:109210.
288. Falcone RA, Morady F, Armstrong WF. Transesophageal echocardiographic evaluation of left atrial appendage function and spontaneous contrast formation after chemical or electrical cardioversion of atrial fibrillation. Am J Cardiol 1996;78:4359.
289. Bellotti P, Spirito P, Lupi G, et al. Left atrial appendage function assessed by transesophageal echocardiography before and on the day after elective cardioversion for nonvalvular atrial fibrillation. Am J Cardiol 1998;81:1199202.
290. Harjai K, Mobarek S, Abi-Samra F, et al. Mechanical dysfunction of the left atrium and the left atrial appendage following cardioversion of atrial fibrillation and its relation to total electrical energy used for cardioversion. Am J Cardiol 1998;81:11259.
291. Mitusch R, Garbe M, Schmucker G, et al. Relation of left atrial appendage function to the duration and reversibility of nonvalvular atrial fibrillation. Am J Cardiol 1995;75:9447.
292. Manning WJ, Silverman DI, Katz SE, et al. Temporal dependence of the return of atrial mechanical function on the mode of cardioversion of atrial fibrillation to sinus rhythm. Am J Cardiol 1995;75:6246.
293. Grimm RA, Leung DY, Black IW, et al. Left atrial appendage stunning after spontaneous conversion of atrial fibrillation demonstrated by transesophageal Doppler echocardiography. Am Heart J 1995;130:1746.
294. Klein AL, Grimm RA, Murray RD, et al. Use of transesophageal echocardiography to guide cardioversion in patients with atrial fibrillation. N Engl J Med 2001;344:141120.
295. Mehta D, Baruch L. Thromboembolism following cardioversion of common atrial flutter. Risk factors and limitations of transesophageal echocardiography. Chest 1996;110:10013.
296. Irani WN, Grayburn PA, Afridi I. Prevalence of thrombus, spontaneous echo contrast, and atrial stunning in patients undergoing cardioversion of atrial flutter. A prospective study using transesophageal echocardiography. Circulation 1997;95:9626.
297. Lazzeroni E, Picano E, Morozzi L, et al. Dipyridamole-induced ischemia as a prognostic marker of future adverse cardiac events in adult patients with hypertrophic cardiomyopathy. Echo Persantine Italian Cooperative (EPIC) Study Group, Subproject Hypertrophic Cardiomyopathy. Circulation 1997;96:426872.
298. Deleted in proof.
299. Kerr CR, Humphries KH, Talajic M, et al. Progression to chronic atrial fibrillation after the initial diagnosis of paroxysmal atrial fibrillation: results from the Canadian Registry of Atrial Fibrillation. Am Heart J 2005;149:48996.
300. Van Gelder IC, Crijns HJ, Tieleman RG, et al. Chronic atrial fibrillation. Success of serial cardioversion therapy and safety of oral anticoagulation. Arch Intern Med 1996;156:258592.
301. Van Gelder IC, Tuinenburg AE, Schoonderwoerd BS, et al. Pharmacologic versus direct-current electrical cardioversion of atrial flutter and fibrillation. Am J Cardiol 1999;84:147R51R.
302. Suttorp MJ, Kingma JH, Koomen EM, et al. Recurrence of paroxysmal atrial fibrillation or flutter after successful cardioversion in patients with normal left ventricular function. Am J Cardiol 1993;71:7103.
303. Prystowsky EN. Management of atrial fibrillation: therapeutic options and clinical decisions. Am J Cardiol 2000;85:311.
304. Singh SN, Fletcher RD, Fisher SG, et al. Amiodarone in patients with congestive heart failure and asymptomatic ventricular arrhythmia. Survival Trial of Antiarrhythmic Therapy in Congestive Heart Failure. N Engl J Med 1995;333:7782.
305. Ehrlich JR, Nattel S, Hohnloser SH. Atrial fibrillation and congestive heart failure: specific considerations at the intersection of two common and important cardiac disease sets. J Cardiovasc Electrophysiol 2002;13:399405.
306. Maisel WH, Stevenson LW. Atrial fibrillation in heart failure: epidemiology, pathophysiology, and rationale for therapy. Am J Cardiol 2003;91:2D8D.
307. Naccarelli GV, Hynes BJ, Wolbrette DL, et al. Atrial fibrillation in heart failure: prognostic significance and management. J Cardiovasc Electrophysiol 2003;14:S281S286.
308. Meng F, Yoshikawa T, Baba A, et al. Beta-blockers are effective in congestive heart failure patients with atrial fibrillation. J Card Fail 2003;9:398403.
309. Steeds RP, Birchall AS, Smith M, et al. An open label, randomised, crossover study ing sotalol and atenolol in the treatment of symptomatic paroxysmal atrial fibrillation. Heart 1999;82:1705.
310. Kuhlkamp V, Schirdewan A, Stangl K, et al. Use of metoprolol CR/XL to maintain sinus rhythm after conversion from persistent atrial fibrillation: a randomized, double-blind, placebo-controlled study. J Am Coll Cardiol 2000;36:13946.
311. Essebag V, Hadjis T, Platt RW, et al. Amiodarone and the risk of bradyarrhythmia requiring permanent pacemaker in elderly patients with atrial fibrillation and prior myocardial infarction. J Am Coll Cardiol 2003;41:24954.
312. Julian DG, Camm AJ, Frangin G, et al. Randomised trial of effect of amiodarone on mortality in patients with left-ventricular dysfunction after recent myocardial infarction: EMIAT. European Myocardial Infarct Amiodarone Trial Investigators [published errata appear in Lancet 1997;349:1180 and 1997;349:1776]. Lancet 1997;349:66774.
313. Cairns JA, Connolly SJ, Roberts R, et al. Randomised trial of outcome after myocardial infarction in patients with frequent or repetitive ventricular premature depolarisations: CAMIAT. Canadian Amiodarone Myocardial Infarction Arrhythmia Trial Investigators [published erratum appears in Lancet 1997 Jun 14;349(9067):1776]. Lancet 1997;349:67582.
314. Kober L, Bloch Thomsen PE, Moller M, et al. Effect of dofetilide in patients with recent myocardial infarction and left-ventricular dysfunction: a randomised trial. Lancet 2000;356:20528.
315. Peters NS, Schilling RJ, Kanagaratnam P, et al. Atrial fibrillation: strategies to control, combat, and cure. Lancet 2002;359:593603.
316. Tsang TS, Petty GW, Barnes ME, et al. The prevalence of atrial fibrillation in incident stroke cases and matched population controls in Rochester, Minnesota: changes over three decades. J Am Coll Cardiol 2003;42:93100.
317. Jackman WM, Friday KJ, Anderson JL, et al. The long QT syndromes: a critical review, new clinical observations and a unifying hypothesis. Prog Cardiovasc Dis 1988;31:11572.
318. Van Noord T, Tieleman RG, Bosker HA, et al. Beta-blockers prevent subacute recurrences of persistent atrial fibrillation only in patients with hypertension. Europace 2004;6:34350.
319. Klingbeil AU, Schneider M, Martus P, et al. A meta-analysis of the effects of treatment on left ventricular mass in essential hypertension. Am J Med 2003;115:416.
320. LAllier PL, Ducharme A, Keller PF, et al. Angiotensin-converting enzyme inhibition in hypertensive patients is associated with a reduction in the occurrence of atrial fibrillation. J Am Coll Cardiol 2004;44:15964.
321. Yusuf S, Sleight P, Pogue J, et al. Effects of an angiotensin-converting-enzyme inhibitor, ramipril, on cardiovascular events in high-risk patients. The Heart Outcomes Prevention Evaluation Study Investigators. N Engl J Med 2000;342:14553.
322. Bosch J, Yusuf S, Pogue J, et al. Use of ramipril in preventing stroke: double blind randomised trial. BMJ 2002;324:699702.
323. Chapman N, Huxley R, Anderson C, et al. Effects of a perindopril-based blood pressure-lowering regimen on the risk of recurrent stroke according to stroke subtype and medical history: the PROGRESS Trial. Stroke 2004;35:11621.
324. Dahlof B, Devereux RB, Kjeldsen SE, et al. Cardiovascular morbidity and mortality in the Losartan Intervention For Endpoint reduction in hypertension study (LIFE): a randomised trial against atenolol. Lancet 2002;359:9951003.
325. Dahlof B, Zanchetti A, Diez J, et al. Effects of losartan and atenolol on left ventricular mass and neurohormonal profile in patients with essential hypertension and left ventricular hypertrophy. J Hypertens 2002;20:185564.
326. Arima H, Hart RG, Colman S, et al. Perindopril-based blood pressurelowering reduces major vascular events in patients with atrial fibrillation and prior stroke or transient ischemic attack. Stroke 2005;36:21649.
327. Wachtell K, Hornestam B, Lehto M, et al. Cardiovascular morbidity and mortality in hypertensive patients with a history of atrial fibrillation: the Losartan Intervention For End Point Reduction in Hypertension (LIFE) study. J Am Coll Cardiol 2005;45:70511.
328. Cox JL, Schuessler RB, Lappas DG, et al. An 8 1/2-year clinical experience with surgery for atrial fibrillation. Ann Surg 1996;224:26773.
329. Cox JL. Cardiac surgery for arrhythmias. J Cardiovasc Electrophysiol 2004;15:25062.
330. Cox JL, Boineau JP, Schuessler RB, et al. Modification of the maze procedure for atrial flutter and atrial fibrillation. I. Rationale and surgical results. J Thorac Cardiovasc Surg 1995;110:47384.
331. Damiano RJ Jr, Gaynor SL, Bailey M, et al. The long-term outcome of patients with coronary disease and atrial fibrillation undergoing the Cox maze procedure. J Thorac Cardiovasc Surg 2003;126:201621.
332. Gillinov AM, McCarthy PM. Advances in the surgical treatment of atrial fibrillation. Cardiol Clin 2004;22:14757.
333. Packer DL, Asirvatham S, Munger TM. Progress in nonpharmacologic therapy of atrial fibrillation. J Cardiovasc Electrophysiol 2003;14:S296S309.
334. Chen SA, Hsieh MH, Tai CT, et al. Initiation of atrial fibrillation by ectopic beats originating from the pulmonary veins: electrophysiological characteristics, pharmacological responses, and effects of radiofrequency ablation. Circulation 1999;100:187986.
335. Lin WS, Tai CT, Hsieh MH, et al. Catheter ablation of paroxysmal atrial fibrillation initiated by non-pulmonary vein ectopy. Circulation 2003;107:317683.
336. Hocini M, Sanders P, Jais P, et al. Techniques for curative treatment of atrial fibrillation. J Cardiovasc Electrophysiol 2004;15:146771.
337. Haissaguerre M, Shah DC, Jais P, et al. Electrophysiological breakthroughs from the left atrium to the pulmonary veins. Circulation 2000;102:24635.
338. Verma A, Marrouche NF, Natale A. Pulmonary vein antrum isolation: intracardiac echocardiography-guided technique. J Cardiovasc Electrophysiol 2004;15:133540.
339. Wazni OM, Marrouche NF, Martin DO, et al. Radiofrequency ablation vs. antiarrhythmic drugs as first-line treatment of symptomatic atrial fibrillation: a randomized trial. JAMA 2005;293:263440.
340. Pappone C, Rosanio S, Oreto G, et al. Circumferential radiofrequency ablation of pulmonary vein ostia: a new anatomic approach for curing atrial fibrillation. Circulation 2000;102:261928.
341. Pappone C, Santinelli V. The who, what, why, and how-to guide for circumferential pulmonary vein ablation. J Cardiovasc Electrophysiol 2004;15:122630.
342. Oral H, Scharf C, Chugh A, et al. Catheter ablation for paroxysmal atrial fibrillation: segmental pulmonary vein ostial ablation versus left atrial ablation. Circulation 2003;108:235560.
343. Cappato R, Calkins H, Chen SA, et al. Worldwide survey on the methods, efficacy, and safety of catheter ablation for human atrial fibrillation. Circulation 2005;111:11005.
344. Nademanee K, McKenzie J, Kosar E, et al. A new approach for catheter ablation of atrial fibrillation: mapping of the electrophysiologic substrate. J Am Coll Cardiol 2004;43:204453.
345. Hsu LF, Jais P, Sanders P, et al. Catheter ablation for atrial fibrillation in congestive heart failure. N Engl J Med 2004;351:237383.
346. Pappone C, Rosanio S, Augello G, et al. Mortality, morbidity, and quality of life after circumferential pulmonary vein ablation for atrial fibrillation: outcomes from a controlled nonrandomized longterm study. J Am Coll Cardiol 2003;42:18597.
347. Marshall HJ, Harris ZI, Griffith MJ, et al. Prospective randomized study of ablation and pacing versus medical therapy for paroxysmal atrial fibrillation: effects of pacing mode and mode-switch algorithm. Circulation 1999;99:158792.
348. Natale A, Zimerman L, Tomassoni G, et al. AV node ablation and pacemaker imtation after withdrawal of effective rate-control medications for chronic atrial fibrillation: effect on quality of life and exercise performance. Pacing Clin Electrophysiol 1999;22:16349.
349. Marshall HJ, Harris ZI, Griffith MJ, et al. Atrioventricular nodal ablation and imtation of mode switching dual chamber pacemakers: effective treatment for drug refractory paroxysmal atrial fibrillation. Heart 1998;79:5437.
350. Hindricks G, Piorkowski C, Tanner H, et al. Perception of atrial fibrillation before and after radiofrequency catheter ablation: relevance of asymptomatic arrhythmia recurrence. Circulation 2005;112:30713.
351. Senatore G, Stabile G, Bertaglia E, et al. Role of transtelephonic electrocardiographic monitoring in detecting short-term arrhythmia recurrences after radiofrequency ablation in patients with atrial fibrillation. J Am Coll Cardiol 2005;45:8736.
352. Karch MR, Zrenner B, Deisenhofer I, et al. Freedom from atrial tachyarrhythmias after catheter ablation of atrial fibrillation: a randomized ison between 2 current ablation strategies. Circulation 2005;111:287580.
353. Haissaguerre M, Jais P, Shah DC, et al. Electrophysiological end point for catheter ablation of atrial fibrillation initiated from multiple pulmonary venous foci. Circulation 2000;101:140917.
354. Ren JF, Marchlinski FE, Callans DJ, et al. Increased intensity of anticoagulation may reduce risk of thrombus during atrial fibrillation ablation procedures in patients with spontaneous echo contrast. J Cardiovasc Electrophysiol 2005;16:4747.
355. Pappone C, Oral H, Santinelli V, et al. Atrio-esophageal fistula as a complication of percutaneous transcatheter ablation of atrial fibrillation. Circulation 2004;109:27246.
356. Scanavacca MI, Davila A, Parga J, et al. Left atrial-esophageal fistula following radiofrequency catheter ablation of atrial fibrillation. J Cardiovasc Electrophysiol 2004;15:9602.
357. Mesas CE, Pappone C, Lang CC, et al. Left atrial tachycardia after circumferential pulmonary vein ablation for atrial fibrillation: electroanatomic characterization and treatment. J Am Coll Cardiol 2004;44:10719.
358. Pappone C, Manguso F, Vicedomini G, et al. Prevention of iatrogenic atrial tachycardia after ablation of atrial fibrillation: a prospective randomized study ing circumferential pulmonary vein ablation with a modified approach. Circulation 2004;110:303642.
359. Andersen HR, Nielsen JC, Thomsen PE, et al. Long-term follow-up of patients from a randomised trial of atrial versus ventricular pacing for sick-sinus syndrome. Lancet 1997;350:12106.
360. Connolly SJ, Kerr CR, Gent M, et al. Effects of physiologic pacing versus ventricular pacing on the risk of stroke and death due to cardiovascular causes. Canadian Trial of Physiologic Pacing Investigators. N Engl J Med 2000;342:138591.
361. Lamas GA, Orav EJ, Stambler BS, et al. Quality of life and clinical outcomes in elderly patients treated with ventricular pacing as ed with dual-chamber pacing. Pacemaker Selection in the Elderly Investigators. N Engl J Med 1998;338:1097104.
362. Lamas GA, Lee KL, Sweeney MO, et al. Ventricular pacing or dualchamber pacing for sinus-node dysfunction. N Engl J Med 2002;346:185462.
363. Knight BP, Gersh BJ, Carlson MD, et al. Role of permanent pacing to prevent atrial fibrillation: science advisory from the American Heart Association Council on Clinical Cardiology (Subcommittee on Electrocardiography and Arrhythmias) and the Quality of Care and Outcomes Research Interdisciplinary Working Group, in collaboration with the Heart Rhythm Society. Circulation 2005;111:2403.
364. Deleted in proof.
365. Blanc JJ, De Roy L, Mansourati J, et al. Atrial pacing for prevention of atrial fibrillation: assessment of simultaneously implemented algorithms. Europace 2004;6:3719.
366. Friedman PA, Ip JH, Jazayeri M, et al. The impact of atrial prevention and termination therapies on atrial tachyarrhythmia burden in patients receiving a dual-chamber defibrillator for ventricular arrhythmias. J Interv Card Electrophysiol 2004;10:10310.
367. Alsheikh-Ali AA, Wang PJ, Rand W, et al. Enalapril treatment and hospitalization with atrial tachyarrhythmias in patients with left ventricular dysfunction. Am Heart J 2004;147:10615.
368. Olsson LG, Swedberg K, Ducharme A, et al. on behalf of the CHARM Investigators. Atrial fibrillation and risk of clinical events in chronic heart failure with and without left ventricular systolic dysfunction. Results from the Candesartan in Heart failure-Assessment of Reduction in Mortality and morbidity (CHARM) program. J Am Coll Cardiol 2006;47:19972004.
369. Young-Xu Y, Jabbour S, Goldberg R, et al. Usefulness of statin drugs in protecting against atrial fibrillation in patients with coronary artery disease. Am J Cardiol 2003;92:137983.
370. Siu CW, Lau CP, Tse HF. Prevention of atrial fibrillation recurrence by statin therapy in patients with lone atrial fibrillation after successful cardioversion. Am J Cardiol 2003;92:13435.
371. Mozaffarian D, Psaty BM, Rimm EB, et al. Fish intake and risk of incident atrial fibrillation. Circulation 2004;110:36873.
Fibrilatia ventriculara este usor de recunoscut prin morfologia haotica, ondulanta, datorata deplasarii continue a impulsului prin cai de cond [...] |
Una dintre tulburarile de ritm cele mai spectaculoase este fibrilatia atriala. Se manifesta prin batai rapide si neregulate, care sunt astfel p [...] |
Riscul pentru embolii sistemice la bolnavi vah-ulari cu fibrilatie atriala este de mult cunoscut. Recent s-a apreciat riscul pentru accident vascul [...] |
Copyright © 2010 - 2025
: eSanatos.com - Reproducerea, chiar si partiala, a materialelor de pe acest site este interzisa!
Informatiile medicale au scop informativ si educational. Ele nu pot inlocui consultul medicului si nici diagnosticul stabilit in urma investigatiilor si analizelor medicale la un medic specialist.
Termeni si conditii - Confidentialitatea datelor - Contact