|
|
Nu demult, termenul de terapie genica, se refera strict la tratamentul unor boli prin inlocuirea unei gene defective cu o copie functionala prin transfer genic. In prezent, terapia genica este definita prin utilizarea transferului unui acid nucleic, fie ARN fie ADN, pentru a trata sau a preveni o boala. Ulterior, terapia genica s-a concentrat in principal, pe boli genetice severe care prezinta dificultati in tratament cu agenti farmacologici sau pe boli letale cum este de exemplu, cancerul.
Pentru ca terapia genica sa aiba succes este important sa se inteleaga clar patogeneza bolii, sa se gaseasca un tesut tinta corespunzator pentru a clona o gena, sa se gaseasca o gena terapeutica eficienta, precum si un model de animale care simuleaza boala in testarile preclinice.
Cele mai multe studii clinice de terapie genica sunt directionate impotriva cancerului deoarece letalitatea bolii precum si prognosticul rau pentru multi pacienti, implica un tratament medicamentos conventional sau un tratament cu radiatii.
Terapia genica promite sa revolutioneze medicina prin tratarea cauzei bolii si mai putin a simptomelor. Rezultatele initiale in ceea ce priveste eficienta terapiei genice au dezamagit datorita utilizarii de vectori inadecvati pentru transferul de gene.
Leucemia mieloida cronica este prima boala neoplazica umana in care s-a descris o anomalie cromozomala constanta si caracteristica: cromozomul Philadelphia (Ph). Este o boala mieloproliferativa cronica, clonala care apare prin transformare neoplazica la nivelul celulei stem multipotente. In faza cronica, pacientii au un numar mare de progenitori mieloizi, celule sangvine precursoare si mature atat in maduva osoasa cat si in sange. Boala poate fi controlata prin monoterapie. Dupa aproximativ 3-5 ani boala evolueaza spre criza blastica in care populatia stem celulara nu se mai diferentiaza, iar blastii mieloizi sau limfoizi se acumuleaza in sange si maduva osoasa. Desi o faza cronica scurta poate fi indusa prin chemoterapie, de obicei pacientii mor la 6-l2 luni de la criza blastica. Cromozomul Philadelphia, care este prezent in cca 95% din pacientii cu leucemie mieloida cronica (LMC), este rezultatul translocatiei reciproce dintre cromozomii 9 si 22.
La nivel molecular, aceasta rezulta in urma translocatiei genei Abelson ( abl ) care codifica un receptor tirozin- kinazic situata pe cromozomul 9, la nivelul genei bcr ( breakpoint cluster region ) situata pe cromozomul 22, ducand la aparitia unui rearanjament genic bcr -abl. In urma transcrierii genei hibride BCR-ABL rezulta o proteina hibrida denumita p210 (ura
Punctul de rupere este situat frecvent intre exonii b2 si b3 sau b3 si b4 din gena bcr, si intre exonii a1 si a2 din gena abl.
Desi este posibila prelungirea vietii pacientilor cu LMC, acestia recidiveaza datorita celulelor maligne care persista in grefa si corp. Diferite strategii experimentale au drept tinta, gena bcr-abl sau produsul acesteia. Acestea au drept scop blocarea transcrierii la nivelul genei bcr-abl, blocarea ARNm sau a proteinei.
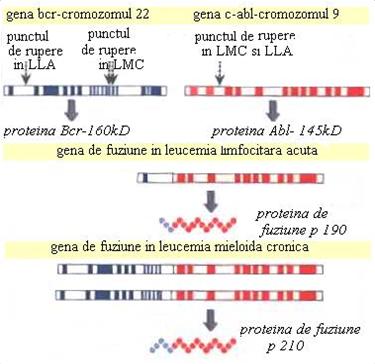
ura 1. Punctele de rupere din leucemiile acute si din leucemia mieloida cronica. In translocatia reciproca t(9;22) sunt implicate genele bcr-breakpoint cluster region, care este situata pe cromozomul 22 si gena abl-gena Abelson, care este situata pe cromozomul 9. (dupa B. Lewin, 2000).
Tratamentul pacientilor cu LMC Ph+ numai cu chemoterapie intensiva nu induce remisiuni citogenetice persistente. Cu toate ca transtul allogenic de celule stem poate fi eficient, aceasta terapie este accesibila la mai putin de 40% dintre pacienti, deoarece boala afecteaza de obicei pacienti de peste 50 de ani. Transtul autolog este considerat o cale alternativa in terapie; exista dovada care sugereaza ca o stare Ph- poate fi indusa prin aceasta terapie si ca autogrefarea poate mari supravietuirea. Din nefericire, apoape toti pacientii vor suferi remisiuni dupa autogrefare datorita persistentei bolii in corp si in grefa.
Terapia genica presupune transferul unei gene terapeutice in interiorul celulelor somatice umane pentru a trata o boala. Adresata initial pentru bolile genetice ereditare, terapia genica a fost utilizata ca terapie in cancer, boli infectioase si degenerative. Aplicatia terapiei genice a fost initial utilizata in tratamentul bolilor ereditare, datorita unui potential clar de a suplimenta cu o gena corecta o functie alterata sau absenta
Primul protocol clinic pentru terapie genica a fost stabilit in 1990 cand un pacient cu sindrom de imunodeficienta combinata severa (SCID) a suferit ex vivo transducerea linfocitelor T periferice cu un vector retroviral al leucemiei murine (MLV) purtator al genei adenozin-deaminaza (ADA). Trei ani mai tarziu, testele au aratat ca mai mult de 30% din celulele T circulante ale pacientilor contineau gena transdusa care se asociaza cu o imbunatatire semnificativa a imunocompetentei.
Un concept original al unei terapii genice de corectie s-a bazat pe salvarea functiei alterate prin furnizarea genei functionale. Aceasta strategie poate consta in:
distribuirea de gene capabile sa ucida celula tinta (terapia genica de sinucidere);
livrarea unor functii sau secvente transdominante, cum ar fi de exemplu molecule antisens sau ribozime capabile de a anula o gena functionala (terapie genica de supresie);
livrarea unor functii imune capabile sa induca sistemul imun sa distruga celulele care exprima determinanti specifici (terapie genica imuna).
Tintirea precisa este inca necesara in cazul cancerului pentru a putea fi siguri ca numai celulele maligne vor fi distruse. Un raspuns imun fata de celulele transduse, dezavantaj nedorit in terapia genica a bolilor ereditare monogenice, devine in schimb un efect de dorit in cazul bolilor maligne ajutand la eliminarea tumorii. Un asemenea raspuns imun sta la baza mai multor cai care au drept scop inducerea unei rejectii a tumorii mediata imun. Imbogatirea tuturor celulelor tinta cu gena terapeutica este dependenta de vectorul utilizat si de celula tinta.
Vectorii retrovirali au mai multe caracteristici care ii fac extrem de aplicabili in terapia genica. Ei isi integreaza genomul in interiorul cromozomilor celulei gazda, permit ca gena terapeutica sa fie mentinuta in generatiile viitoare o lunga perioada de timp. Acesti vectori pot transduce secvente de pana la 10Kb care permit transferul unor gene relativ mari. De asemenea ei nu codifica pentru proteine virale care ar putea sa activeze un raspuns imun fata de celulele transduse. Vectorii retrovirali derivati din oncoretrovirusuri, cum este de exemplu virusul leucemiei murine (MLV) sunt primii vectori utilizati in incercari clinice si sunt inca cei mai populari vectori din terapia genica. Ei pot fi produsi in cantitati mari, concentrati prin ultrafiltrare, purificati si mentinuti o lunga perioada de timp fie la temperaturi mici, fie liofilizati. Acesti vectori au insa doua dezavantaje majore: nu pot transduce celulele care nu se divid si sunt sensibili la complementul uman. Ambele caracteristici limiteaza aplicabilitatea acestor vectori in cazul transductiei directe in vivo.
Metode de blocare a genei
Datorita prezentei proteinei hibride p210 Bcr-Abl in LMC Ph+ exista ipoteza ca supresia sintezei p210 sau a proteinelor localizate in aval in calea de semnalizare activata specific de p210 va restabili cresterea normala, non-leucemica. Exista metode care pot perturba fluxul informatiei genice in celula, acestea fiind reprezentate de:
-strategii orientate asupra genei tinta,
-strategii orientate asupra ARNm tinta,
-strategii orientate asupra proteinei tinta.
Strategii orientate asupra genei tinta
Din cadrul acestei strategii fac parte: recombinarea omoloaga, oligonucleotidele formatoare de triplu-helixuri (ODN), oliginucleotide capcana pentru factori de transcriere (TFO).
Recombinarea omoloaga este de obicei utilizata pentru a elimina sau a introduce anumite gene in celule stem embrionare sau in linii celulare cultivate. Aceasta cale este un instrument de baza pentru a caracteriza functia genelor care au fost indepartate sau introduse intr-un organism. Totusi este o metoda ineficienta si este putin probabil sa fie utilizata in scopuri terapeutice.
Oligonucleotidele formatoare de triplu-helixuri reprezinta o metoda antigenica care utilizeaza ODN sintetice care hibridizeaza cu ADN dublu catenar. Aceste ODN-uri inhiba transcriptia genica, probabil prin prevenirea legarii factorilor de transcriere sau prin prevenirea desfasurarii dublului-helix. Deoarece formarea triplu-helixului este instabila in vivo, aceasta cale nu este inca utilizata in terapiile clinice.
Oligonucleotidele capcana pentru factori de transcriere sunt secvente specifice de acid nucleic care competitioneaza cu secventa nativa ADN pentru recrutarea factorilor transcriptionali. TFO supreseaza transcriptia genelor care depind de factorii de transcriere impotriva carora este directionat TFO.
Strategii orientate asupra ARNm tinta
Aceste strategii au drept scop
tintirea ARNm si se numesc strategii
antisens. Enzimele ARN sau ribozimele sunt molecule ARN care promoveaza o
varietate de reactii care implica molecule de ARN sau ADN. Aceste reactii
includ: clivarea sit-spcifica, ligare si polimerizare de nucleotide, formarea
de amide si de legaturi carbon-carbon. Utilizarea terapeutica a ribozimelor a
fost apreciata dupa ce a fost descoperita cataliza ARN.
Datorita dimensiunii lor mici si a specificitatii foarte mari, ribozimele self-cleaving (cum sunt de exemplu ribozimele hammerhead si hairpin) au aplicabilitate in medicina. Ribozimele reprezinta mici molecule de ARN care contin 24 de nucleotide conservate care flancheaza secventa complementara la 3si 5 cu secventa tinta care inconjoara secventa situsului de rupere (GUA, GUC, GUU). Independent de un efect antisens, componenta catalitica a ribozimei cliveaza ARNm conducand la distrugerea fizica a ARN.
Se pot utiliza fie ribozime, fie ODN-uri antisens. Fie se transfera secventa in interiorul celulei tinte, fie se exprima secventa in celula tinta prin intermediul unui vector viral.
Strategii orientate asupra proteinei tinta
Aceasta strategie se concentreaza pe oncoproteina ca si cum ar reprezenta tinta pentru
distrugerea genei. Aceasta cale implica introducerea de anticorpi care sunt alcatuiti dintr-un singur lant numiti intracorpi, in interiorul celulei. Intracorpul reprezinta un recombinant al domeniului variabil al lantului usor (VL) cu un domeniu variabil al lantului greu (VH). Intracorpul poate fi cuplat cu o secventa care il conduce spre o localizare intracelulara specifica, schimba directia proteinei tinta spre o localizare diferita de localizarea obisnuita in interiorul celulei, anuland eficient functia sa. Un intracorp poate fi directionat si impotriva unui domeniu functional important al proteinei tinta, cum ar fi de exemplu un domeniu tirozin-kinazic, pentru a bloaca functia sa.
TERAPII ANTI BCR-ABL
Deoarece p210 este specifica tumorii si responsabila de dezvoltarea LMC, este evident ca reprezinta o tinta terapeutica. Genele native c-bcr si c-abl au functii importante in celula. c-abl este exprimata ubicvitar si de obicei este localizata in nucleu unde poate juca un rol in transcrierea genica. Alterarea protooncogenei c-abl in soareci induce dezvoltarea anormala a celulelor B si T, iar ODN antisens anti-c-abl inhiba cresterea CFU-GM care sunt prezente in maduva osoasa normala. In acelasi mod, c-bcr conduce la o explozie a neutrofilelor marita, avand drept rezultat socul termic si ranirea crescuta a tesutului de catre neutrofile.
Terapia anti BCR-ABL este tintita la punctul de rupere bcr-abl si nu asupra portiunilor bcr si abl ale oncogenei sau ale oncoproteinei. Ca o alternativa terapeutica se poate urmari 'tintirea
Mai multe studii au examinat efectul ODN antisens sau a ribozimelor directionate asupra punctului de rupere bcr-abl in linii celulare leucemice sau in progenitorii primari umani leucemici.
Cand secventa b3a2 BCR-ABL este introdusa in liniile celulare hematopoietice umane sau murine, ele devin in mod obisnuit independente de factorul de crestere, rezistente la apoptoza si devin tumorale in vivo.Cand asemenea celule sunt expuse la ODN complementare cu jonctiunea b3a2 BCR-ABL, celulele isi recapata dependenta lor fata de factorul de crestere si sensibilitatea lor la stimulii apoptotici si nu mai sunt leucemogenice in vivo. Cand celulele primare leucemice obtinute de la pacienti aflati in criza blastica sunt expuse la ODN anti BCR-ABL, CFU-GM leucemice sunt supresate, nu insa si CFU-GM normale. Progenitorii leucemici nu mai pot supravietui mult timp in absenta citokinelor si serului. In plus, adeziunea mediata de b-integrina si controlul cresterii progenitorilor leucemici sunt normalizate dupa tratamentul cu ODN anti BCR-ABL. Rezultate similare sunt descrise in cazul tratamentului liniilor celulare leucemice sau a progenitorilor primari cu ribozime anti BCR-ABL. Mai multe studii au aratat eficienta ribozimelor in vederea eliminarii ARNm tinta, care poate fi mai mare decat aceea a ODN simple.
TINTIREA MOLECULELOR SITUATE IN AVAL
Desi BCR-ABL este o tinta evidenta in cazul terapiei antisens in LMC, exista motivul de a crede ca nu poate fi o tinta unica. Tratamentul ODN va fi eficient numai daca celulele nu tolereaza controlul in aval tranzient al ARNm si oncoproteinei. Moleculele situate in aval fata de BCR-ABL, se crede a fi importante in transformarea oncogenica a LMC. Aceste molecule sunt reprezentate de : c-Myb, c-Myc, c-Kit, c-Vav. ODN antisens directionate asupra acestor tinte supreseaza cresterea blastilor leucemici mult mai semnificativ decat supreseaza cresterea CFU-GM normale. Totusi, toti acesti factori de transcriere joaca un rol important in cresterea celulara normala, iar eliminarea lor, cel putin teoretic, poate sa induca supresia generalizata a maduvei osoase.
TERAPIA GENICA ANTI-BCR-ABL DE REZISTENTA LA MEDICAMENTE
Deoarece expunerea tranzienta la secventa antisens nu conduce la o eliminare a clonei maligne, s-ar putea introduce o secventa anti-BCR-ABL in interiorul genomului care apoi sa o produca in mod continuu pe intreaga durata de viata a celulei si a progenitorilor ei.
Producerea continua de secvente anti BCR-ABL vor supresa apoi expresia BCR-ABL pe termen lung. Pentru a se realiza aceasta s-a proiectat un vector retroviral care contine 2 copii ale unei secvente antisens BCR-ABL anti b3a2 numit Las BD. Markerul de selectie din vectorul Las BD este o gena pentru dihidro-folat-reductaza (DHFR) Tyr 22, care permite ca celulele care au fost transformate sa reziste la concentratii mari de methotrexat (MTX) (ura 2).
Liniile celulare hematopoietice care contin ADNc BCR-ABL b3a2
au fost transformate cu Las BD si selectate in MTX dupa 14 zile. Au fost detectate nivele mari de
ARN antisens, precum si normalizarea cresterii celulare si
a tumoriginecitatii in vivo. Deci, secventa antisens exprimata de vectorul Las
BD supreseaza expresia genei bcr-abl suficient pentru a restabili comportamentul in vivo si in vitro a
celulelor care contin ADNc bcr-abl. Asemenea vectori pot fi desemnati sa
incorporeze ribozime anti BCR-ABL. Se poate utiliza de asemenea un intracorp
anti BCR-ABL care poate insoti fie strategiile antisens fie strategiile de
tip ribozima care sunt directionate la nivelul ARNm si nu la nivel
de proteina. Din pacate nici un anticorp monoclonal
specific b3a2 sau b2a2 nu a fost produs.
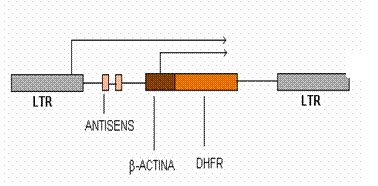
ura 2. Vectorul retroviral Las BD contine doua copii ale secventei antisens anti-bcr abl, precum si gena DHFR. Gena DHFR este reglata transcriptional printr-un promotor al genei pentru β-actina de la pui. Secventele antisens anti b3a2 sunt reglate prin regiunea LTR al virusului MMuLV (moloney murine leukemia virus) (dupa Molecular Medicine Today).
Desi administrarea in vivo a genelor care contin antisensul poate reprezenta o cale atractiva, sistemele livratoare de gene virale sau non-virale nu sunt suficiente din punct de vedere specific sau eficiente astfel incat sa poata tinti in vivo toate celulele stem leucemice. Aplicatia practica a unei asemenea metode consta in punerea la punct a unui protocol de autogrefare. Din pacate, manipularea genetica a unei grefe de celule stem este dificila datorata mai multor probleme: transferul retroviral de gene in HSC este foarte ineficient, de obicei fiind mai mic de 1%. Totusi, studii recente sugereaza ca cca 2% din celulele stem de origine umana pot fi transformate retroviral daca sunt utilizate citokine pentru a induce proliferarea celulelor stem. Ramane foarte improbabli ca eficienta transformarii de 100% sa fie atinsa cu ajutorul acestei metode.
O alta problema este aceea ca, chiar daca vectorul retroviral introdus in grefa elimina o fractie de celule stem maligne, pacientii tot vor suferi recaderi deoarece boala persista in corp. Astfel ipoteza transferului unei secvente anti BCR-ABL si o gena de rezistenta la medicament poate inlatura ambele probleme. Dupa transtul cu celulele stem care au fost transfectate cu o gena de rezistenta la medicament, pacientii continua chemoterapia pentru a elimina celulele leucemice care persista in corp si celulele stem leucemice non-transfectate in grefa. In acest timp se selecteaza celulele stem normale rezistente la medicament. Desi chemoterapia va selecta celulele stem leucemice care persista in grefa, prezenta secventei anti BCR-ABL va oferi celulelor functia normala.
O familie de gene de rezistenta la medicament este reprezentata de genele DHFR care in mod normal sunt inhibate de agentul chemoterapic MTX. Activitatea antiproliferativa il face un agent antitumoral eficace in tratamentul a numeroase boli maligne. Din pacate, MTX este toxic pentru tesuturile normale, inclusiv pentru celulele hematopoietice normale si pentru epiteliul gastrointestinal. Manipularile care urmaresc toleranta la MTX pot permite doze mari de MTX ce poate fi administrat, sporind posibilitatea eliminarii tumorii. Toleranta hematologica si gastrointestinala marita la MTX poate fi obtinuta prin insertia unei gene DHFR rezistenta la MTX in interiorul HSC.
Cea mai testata gena de rezistenta la MTX este varianta Arg 22 murina (leucina este substituita de arginina la nivelul codonului din pozitia 22) care a fost utilizata in mod extensiv ca un marker dominant de selectie in sistemele mamaliene. Transfectia maduvei de caine si om cu un vector viral care codifica proteina DHFR-Arg 22 are ca rezultat rezistenta la MTX a progenitorilor in vitro. Transtarea celulelor stem transfectate cu virusul ce contine gena DHFR Arg 22 mareste durata de supravietuire a soarecilor care sunt ulterior tratati cu MTX.
METODA INTRACORPILOR
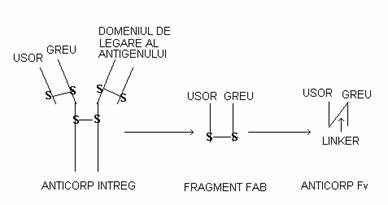
Genele anticorpilor de origine umana si anticorpii directionati impotriva proteinelor umane au devenit in mare masura disponibili in ultimii ani. Acestia sunt reactivi valorosi in aplicatiile de terapie genica, in care utilizarea genelor si proteinelor umane permit o eficienta terapeutica marita. O aplicatie a anticorpilor in terapia genica este utilizarea de anticorpi exprimati in interiorul celulei (intracorpi ) ca agenti terapeutici. Anticorpi cu un singur lant (Fv) contine regiunea variabila conectata la un linker mic flexibil situat intre lanturi. La aceasta forma monovalenta de domeniu de legare la antigen, pot fi adaugate secvente care sa confere o functie aditionala anticorpului (ura 3).
Astfel de secvente pot fi reprezentate de domenii de oligomerizare, domenii de legare la ADN, semnale de localizare intracelulara, factori de crestere etc.
 Anticorpii reprezinta
componenete excelente de tintire a genei prin intermediul unor vehicule,
facandu-i inhibitori intracelulari eficienti ai unor molecule tinta. Astfel, o
gena care codifica un fragment de anticorp este introdusa in interiorul unor
celule receptoare. Gena se exprima iar proteina anticorp este produsa si se
leaga la molecula tinta, inhiband functia acesteia. Prin includerea semnalelor
intracelulare de localizare, potenta inhibitiei poate fi marita localizand
intracorpul la nivelul situsului de activitate al moleculei tinta. Terapiile
care se bazeza pe ARN, cum ar fi ribozime si ARN antisens sunt mai putin
stabile decat intracorpii si pot fi utilizati numai pentru ARN.
Anticorpii reprezinta
componenete excelente de tintire a genei prin intermediul unor vehicule,
facandu-i inhibitori intracelulari eficienti ai unor molecule tinta. Astfel, o
gena care codifica un fragment de anticorp este introdusa in interiorul unor
celule receptoare. Gena se exprima iar proteina anticorp este produsa si se
leaga la molecula tinta, inhiband functia acesteia. Prin includerea semnalelor
intracelulare de localizare, potenta inhibitiei poate fi marita localizand
intracorpul la nivelul situsului de activitate al moleculei tinta. Terapiile
care se bazeza pe ARN, cum ar fi ribozime si ARN antisens sunt mai putin
stabile decat intracorpii si pot fi utilizati numai pentru ARN.
ura 3. Structura generica a unei molecule de anticorp Ig G este ilustrata in partea stanga a urii. In centrul urii este schematizata structura unui fragment Fab monovalent, care poate rezulta in urma unui tratament proteolitic a intregului anticorp. In dreapta urii se observa structura unui anticorp cu un singur lant (Fv) in care domeniul de legare al antigenului al lanturilor usor si greu sunt covalent linkate printr-un linker flexibil. (dupa S.D. Jones, 1998).
Alte terapii care se bazeaza pe proteine, cum ar fi de exemplu inhibitoii dominanti negativi se bazeaza pe competitia cu specii de legare native si deci necesita concentratii mari pentru a putea fi realizate. Anticorpii pot fi generati sa reactioneze cu orice componenta intracelulara, inclusiv proteine, acizi nucleici, carbohidrati, lipide sau alte componente celulare. Oncologia este una dintre aplicatiile in terapia genica a intracorpilor care deja se aplica in clinica. Puterea intracorpilor de a inhiba functia celulara sau oncogenica a fost demonstrata in mod repetat si a fost gasita ca fiind cea mai eficienta cale pentru a inhiba o varietate de componente intracelulare.
Expresia intracorpilor impotriva oncogenelor sau a moleculelor de semnalizare cunoscute fac ca celulele tumorale sa isi intrerupa cresterea necontrolata si sa intre eventual intr-un ciclu de apoptoza. Tratamentul liniilor celulare tumorale cu intracorpi directionati impotriva proteinelor transformante au redus cresterea tumorala in studiile pe animale. Intracopii pot fi utilizati in purificarea maduvei osoase recoltata de la pacienti cu cancer. Celulele medulare osoase recoltate de la pacienti pentru transtul autolog de maduva osoasa au aratat ca, contin celule maligne care conduc la recaderea bolii ulterior reinfuziei. Celulele maligne din interiorul preparatului pot fi tintite de catre intracorpi care intrerup in mod specific cresterea celulelor tumorale. Asemenea intracorpi pot fi directionati impotriva unor oncoproteine cunoscute. Asemenea oncogene au fost identificate pentru mai multe tipuri de cancere si sunt implicate in general in transducerea semnalului factorului de crestere.
Concluzii
Tratamentul acestei neoplazii are drept ameliorarea simptomelor si reducerea riscului de complicatii severe. Totusi unii pacienti pot fi vindecati in urma tratamentului medular. Terapia genica pentru LMC presupune recoltarea maduvei in perioada de remisiune, supunerea acesteia la una sau mai multe metode de terapie genica prezentate mai sus , si reimtare la acelasi pacient a celulelor stem transfectate. Din pacate, nici o metoda nu a aratat in clinica un beneficiu clar in ceea ce priveste curatarea maduvei osoase sau a eliminarii clonei maligne. Cu toate ca metodele de terapie genica ofera mari sperante, inca nu exista o metoda care sa fie aplicabila in clinica si sa demonstreze o eficienta de 100% in ceea ce priveste eliminarea clonei maligne din corp. Ramane ca in viitor sa se reuseasca punerea la punct a unei metode care sa inlature dezavantajele metodelor actuale.
Bibliografie
Hauswirth W. William, Lewin S. Alfred RIBOZYME USES IN RETINAL GENE THERAPY, Progress in Retinal and Eye Research, Vol 19, No 6, 2000;
Jones Susan Dana, Marasco A. Wayne ANTIBODIES FOR TARGET GENE THERAPY: EXTRACELLULAR GENE TARGETING AND INTRACELLULAR EXPRESSION , Advantage Drug Delivery Reviews, 31, 1998;
Kantarjian Hagop BIOTHERAPY OF CANCER AND HEMATOLOGIC CONDITIONS , Vol 1, No 5, 1996;
Mountain Andew GENE THERAPY: THE FIRST DECADE, TIBTECH MARCH 2000 (vol. 18);
Kolibaba S. Kathryn, Druker J. Brian PROTEIN TYROSINE-KINASES AND CANCER , Biochimica et Biophysica Acta, 1333, 1997;
Lewin Benjamin GENES VII, Oxford University Press, 2000;
Palu Giorgio et al IN PURSIT OF NEW DEVELOPMENTS FOR GENE THERAPY OF HUMAN DESEASE , Journal o Biotechnology 68, 1999;
Robbins D. Paul VIRAL VECTOR FOR GENE THERAPY, Pharmacol. Ther. Vol. 80. No. 1, 1998;
Verfaille M. Catherine et al GENE THERAPY FOR CHRONIC MYELOGENOUS LEUKEMIA , Molecular medicine Today, Aug. 1999.
Notiunea de sistem reprezinta in gandirea stiintifica contemporana nu o "moda", ci un instrument necesar intelegerii fenomenelor biologice in mod spec [...] |
Un dicton intelept spune ca natura nu cunoaste probleme, ci numai solutii. Desigur ca nu este usor de definit in mod exhaustiv ceea ce este natural sa [...] |
Pe calea unor indelungate tatonari, facute si prin propria experienta, fiinta umana a acumulat o seama de mijloace terapeutice, consolidand - in decur [...] |
Copyright © 2010 - 2025
: eSanatos.com - Reproducerea, chiar si partiala, a materialelor de pe acest site este interzisa!
Informatiile medicale au scop informativ si educational. Ele nu pot inlocui consultul medicului si nici diagnosticul stabilit in urma investigatiilor si analizelor medicale la un medic specialist.
Termeni si conditii - Confidentialitatea datelor - Contact